下列各组物质
①CH4和C3H8 ②醋酸和乙酸
③CH3CH2CH2CH3和 ④氕、氘、氚
④氕、氘、氚
请将正确的序号填在横线上:
属于同种物质的是__________________;互为同位素的是_________________;
互为同系物的是_____________________;互为同分异构体的是_______________。
Ⅰ.有下列各组物质:
| A.O2和O3(臭氧) |
B.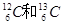 |
| C.CH3CH2CH2CH3和CH3CH(CH3)2 |
D.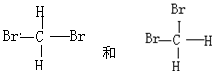 |
E.葡萄糖和果糖 F.(CH3)2CH2与C(CH3)4
G.淀粉和纤维素 H.液氯与氯气
(1)组两物质互为同位素(2)组两物质互为同素异形体
(3)组两物质属于同系物(4)组两组物质互为同分异构体
(5)组中的物质是同一物质(6)D中任意一者与氯气反应的一个化学方程式
Ⅱ.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号下同)属于烯烃的是,
(2)上图中与B互为同分异构体但不属于同种类的物质的是:。
Ⅲ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。则(1)此有机物的相对分子质量为__________;(2)此有机物的分子式为____________;其可能的结构简式为。
工业上冶炼铝时需用到一种熔剂冰晶石(Na3AlF6),工业制冰晶石的化学方程式为:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)写出工业冶炼铝时阳极电极反应式。
(2)在上述反应的反应物和生成物中,属于酸性氧化物的化合物的电子式。
(3)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属强弱的是(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(4)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为。
aAm+、aBn+、cCm-、dDn-为四种短周期元素的离子,它们的核外电子排布相同,已知m>n。请根据元素周期表和元素周期律的相关知识回答与该四种元素有关的问题。(排序问题均用A、B、C、D表示)
(1)试比较四种元素以下各数据的大小:
原子序数:原子半径:离子半径:族序数:
①A﹥B﹥C﹥D②A﹥B﹥D﹥C③D﹥C﹥A﹥B
④B﹥A﹥C﹥D⑤A﹥B﹥C﹥D⑥C﹥D﹥B﹥A
(2)用一个等式表示amdn之间的关系:
(3)若m、n均大于2,试写出C、D形成的氢化物的分子式并比较两者的稳定性:。
(11)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状态下的体积:;
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;乙溶液;丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?。
锂离子电池的广泛应用使回收利用锂货源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下: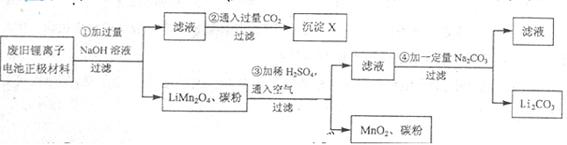
(1)第②步反应得到的沉淀X的化学式为。
(2)第③步反应的离子方程式是。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:、。