“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是
| A.乙烯聚合为聚乙烯高分子材料 | B.甲烷与氯气制备一氯甲烷 |
| C.以铜和浓硝酸为原料生产硝酸铜 | D.用二氧化硅制备高纯硅 |
下列反应需要加入氧化剂才能实现的是
| A.Cl2→Cl- | B.H+ →H2 | C.MnO2 →Mn2+ | D.Zn→Zn2+ |
将一小块钠投入下列溶液时,既能产生气体又会出现白色沉淀的是
| A.稀H2SO4 | B.硫酸铜溶液 | C.氢氧化钠溶液 | D.氯化镁溶液 |
某粒子用符号 M
M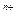 表示,下列关于该粒子的叙述中,正确的是
表示,下列关于该粒子的叙述中,正确的是
| A.所含质子数为(A-n) | B.所含中子数为(A-Z-n) |
| C.所含电子数为(Z+n) | D.中子数-电子数=A-2Z+n |
只含有一种元素的物质不可能是
| A.混合物 | B.化合物 | C.纯净物 | D.单质 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为()
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |