重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
(1)在实验室中,下列实验中所选用的仪器或操作合理的是_____________
| A.用200mL量筒量取5.25mL稀H2SO4 |
| B.用托盘天平称取11.7gNaCl晶体 |
| C.用100mL烧杯配制50g质量分数约为1%的食盐水 |
| D.用500mL容量瓶配制250mL0.20mol/L的氢氧化钠溶液 |
E.给试管中的液体加热时,液体不少于试管容积的1/3
F.盛装Ca(OH)2溶液的试剂瓶可用玻璃塞
G.萃取分液时,先将上层液小心从上口倒出,再将下层液从下口流出
H.蒸馏时,温度计水银球放入液面以下,但不可触及瓶底或沸石
(2)乙醇(俗名酒精)的结构简式为CH3CH2OH,其分子式为C2H6O,相对分子质量为______________,摩尔质量为_____________
(3分)有Mg、Al、Fe的混合粉末4.4g与适量稀H2SO4恰好完全反应。将反应后的溶液蒸干,得到不含结晶水的固体14.0g,则反应过程中生成气体体积(标准状况)为______L。
(7分) 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 ml 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式。
(2)实验②中化学反应转移电子的物质的量是。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是。
(10分)下图中A~J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A~E和F~J中分别含有同一种元素。反应E→A+O2的条件未标出。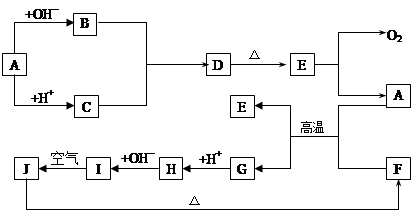
请填写下列空白:
(1)化合物H中的阳离子是;D的化学式为。
(2)A生成B反应的离子方程式是。
(3)A和F的混合物发生反应的化学方程式是。
(4)写出B与C生成D的离子方程式。
(5)I→J反应的化学方程式是。
(8分) 某无色透明的溶液可能含有K+、Cu2+、Ca2+、Br—、SO42—、CO32—、Cl—中的几种,进行如下实验:
(1)滴加氯化钡溶液,有白色沉淀产生。将沉淀滤出,并将滤液分为两份,产生的沉淀可部分溶于稀硝酸。
(2)取一份滤液,向其中加入氯水并加入四氯化碳,振荡后静置,四氯化碳层呈橙色。
(3)向另一份滤液中加入硝酸银溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
(4)取原溶液做焰色实验,透过蓝色钴玻璃观察到紫色。
试判断:该溶液中一定有离子,肯定没有离子,可能有离子。要进一步确定可能存在的离子,还需要做的实验是