有A、B、C、D四种元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层电子只有一个。请回答下列问题:
(1)ACl3分子中A的杂化类型为 。ACl3分子的空间构型为 。
(2)某同学根据上述信息,推断B的核外电子排布如右图所示,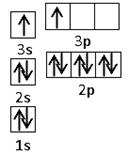
该同学所画的电子排布图违背了 。
(3)A、B、C三元素原子第一电离能由大到小的顺序为 (用元素符号表示)。C60分子中每个原子只跟相邻的3个原子形成共价键,且每个原子最外层都满足8电子稳定结构,则C60分子中π键的数目为 。
(4)D的基态原子有 种能量不同的电子;D2+ 的价电子排布式为 。已知D晶体中微粒的堆积方式为面心立方堆积,晶体中一个晶胞的边长为a cm,则D晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数的值)。
由碳、氢、氧三种元素组成的某有机物,分子中共含有10个原子,其原子
核外共有32个电子,lmol该有机物在氧气中完全燃烧时需要4molO2,回答:
(1)求该有机物的分子式。
(2)若该有机物可使溴水褪色,但不发生银镜反应,取2mol该有机物与足量钠反应,
能产生22.4L H2(标准状况),则该有机物的结构简式可能是什么?
(3)若该有机物能发生银镜反应,则其结构简式是什么? 并写出该有机物发生银镜反应的化学方程式。
根据图示填空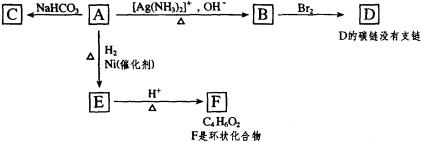
(1)化合物A中含有的官能团是。(填名称)
(2)1mol A与2mo H2反应生成1moE,其反应方程式是。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是;由E生成F的反应类型是。
有机物A分子组成为C4H9Br,分子中有一个甲基支链,在一定条件下A发生如下转化: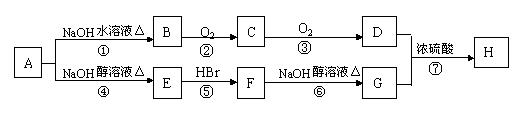 已知:①不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如:
已知:①不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如: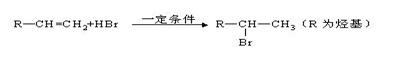
②连接羟基的碳原子上没有氢原子的醇如:  不能发生催化氧化反应。
不能发生催化氧化反应。
(1)A的结构简式为B—H中,与A互为同分异构体的有机物是(填字母代号)
(2)上述转化中属于取代反应的有(填序号)
(3)C的结构简式为
(4)写出反应④的化学方程式,
A、B、C、D、E、F六种短周期元素,原子序数依次增大。A是地壳中含量最高的元素,C是地壳中含量最高的金属元素,A、E同主族。D元素原子最外层电子数是次外层电子数的一半。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。
回答下列问题:
(1)元素A在元素周期表中的位置是。
(2) 写出B、E两元素形成化合物的电子式:,所含化学键类型;
(3)A、D、E、F的气态氢化物的稳定性顺序(用化学式表示)
(4)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
(5)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:
、
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
|
||||||||||||||||
| |
② |
|
③ |
④ |
⑤ |
⑥ |
|
||||||||||
| |
⑦ |
|
|
|
|
|
⑧ |
|
|||||||||
| |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
(1)上表中元素⑨对应的二价阳离子未成对电子数目为______________。
(2)由元素③形成的一种不导电单质晶体,其名称为__________,该单质晶体类型为_________________,
在该晶体中,元素③的原子个数与形成的共价键键数之比为。
(3)元素⑦与①⑤形成的化合物的化学键类型有_________ __________;根据对角线规则,元素②与⑧形成的物质为___________(填“离子化合物”或“共价化合物”)。
(4)元素④与元素①形成的X分子的空间构型为__________,用氢键表示式写出X分子间存在的氢键
_________________________。
(5)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________________________________________________。
(6)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________________________________________。
(7)元素⑩的蓝色硫酸盐溶液显______性,用离子方程式表示其原因____________。