硫酸是工业生产中重要的产品之一,以黄铁矿为原料生产硫酸的简单流程如下图所示。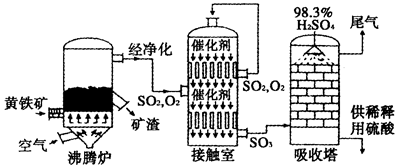
请填写下列空白。
(1)黄铁矿燃烧生成SO2的化学方程式为_____________;接触室中发生反应的化学方程式为____________________。
(2)为充分利用反应放出的热量,接触室中应安装_____________(填设备名称);吸收塔中填充有许多瓷管,其作用为__________________。
(3)为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为____________________(设空气中氧气的体积分数为0.20);将上述炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为________________%。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式为___________________。
(5)硫酸的用途非常广泛,可应用于下列____________(可多选)。
a.橡胶的硫化 b.过磷酸钙的制备
c.铅蓄电池的生产 d.表面活性剂“烷基苯磺酸钠”的合成
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).
填写下列空白:
(1)长颈漏斗C中应加入___________;实验时,U型管B中应加入的试剂是_______。烧瓶D中发生的反应有时要加入少量硫酸铜溶液,其目的是_________________ 。
(2)试管F中发生反应的化学方程式是______________________________。
(3)实验进行时,烧瓶G的作用是__________________________;
烧瓶I的作用是___________________________。
(4)在A、D、F、G、I各仪器中,在实验时不需要加热的仪器是(填该仪器对应的字母)_____________。
(5)为了安全,在A管中的反应发生前,在E出口处必须_____________;A管中的反应开始后,在E出口处应 ___________________________。
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: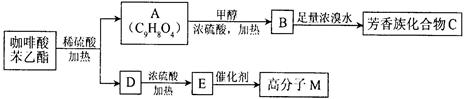
请填写下列空白。
⑴D分子中的官能团是________。
⑵高分子M的结构简式是______________。
⑶写出A→B反应的化学方程式:_____________。
D→E反应的化学方程式:________。
⑷B→C发生的反应类型有_______和_______。
⑸A的同分异构体很多种,其中,请写出同时符合下列条件的所有同分异构体的结构简式____________
①苯环上只有两个取代基;②能发生银镜反应;
③能与碳酸氢钠溶液反应;④能与氯化铁溶液发生显色反应。
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。

 |
图Ⅰ
(1)图Ⅰ中仪器C的名称:_________________。
(2)同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图。B中发生反应的离子方程式为_________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物 中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①__________________;②___________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器 a b c h。
a b c h。
图Ⅱ
①B内需加入固体试剂的名称为_________,B中能产生氨气和氧气混合气体的原因是_________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的化学方程式为__________________。
10已知A、B、D、E均为中学化学常见单质及化合物,它们之间的转化关系如图所示(部分产物略去)
(1)若A和E均为单质且B物质为极性键形成的非极性分子。B的结构式为____。
(2)若A为可溶性强碱(MOH),E为同主族元素形成的常见非金属化合物,且该化合物中两种元素的质量比为1:1,试写出A到B的化学方程式______。
(3)若取B的溶液装于试管,向溶液中滴加KSCN溶液,无明显现象,再滴加稀盐酸,产生红色溶液,则用化学方程式表示工业制备E化学原理______;D的溶液中含有少量B,用离子方程式表示除杂方法_______。
有短周期元素A、B、C、D、E,已知:
①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜 ② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
③ E与A同周期,C、D、E三种元素形成的单质或化合物可发生如下图所示的反应。
请用化学式或相应的符号回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式;
(2)B元素在元素周期表第周期第族;
B的固态氧化物的晶体类型是;
(3)D元素的原子结构示意图是:;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱>;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:。