镁铝合金6.3 g完全溶于稀硝酸,若反应中硝酸被还原只产生4.48L(标准状况下)NO气体,在反应后的溶液中,加入足量Imol.L-I的NaOH溶液,生成沉淀的质量为
| A.8.7 g | B.7.8 g | C.16.5 g | D.4.0g |
1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
| A.化学不再是纯实验科学 | B.化学不再需要实验 |
| C.化学不做实验,就什么都不知道 | D.未来化学的方向还是经验化 |
铁镍蓄电池,放电时的总反应为: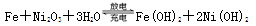 下列有关该电池的说法不正确的是
下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
在铝—铜—浓硝酸原电池中,当导线中有1mol电子通时,理论上的两极变化是
①铝片溶解9g②铜片溶解32g③铜片上析出1 gH2 ④铝片上析出1mol NO2
| A.①③ | B.①④ | C.②③ | D.②④ |
发射“嫦娥一号”月球探测卫星的长征三号甲运载火箭的第三子级使用的燃料是液氢和液氧,已知下列热化学方程式:
①H2(g)+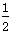 O2(g)=H2O(l) ΔH1=-285.8 kJ/mol
O2(g)=H2O(l) ΔH1=-285.8 kJ/mol
②H2(g)=H2(l) ΔH2=-0.92 kJ/mol
③O2(g)=O2(l) ΔH3=-6.84 kJ/mol
④H2O(l)=H2O(g) ΔH4=+44.0 kJ/mol
则反应H2(l)+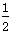 O2(l)=H2O(g)的反应热ΔH为
O2(l)=H2O(g)的反应热ΔH为
| A.+237.46 kJ/mol | B.-474.92 kJ/mol |
| C.-118.73 kJ/mol | D.-237.46 kJ/mol |