下表是部分短周期元素的相关信息:
| 元素代号 |
L |
M |
T |
Q |
R |
| 原子半径/nm |
0.154 |
0.130 |
0.118 |
0.102 |
0.073 |
| 主要化合价 |
+1 |
+2 |
+3 |
+6、-2 |
-2 |
下列判断正确的是
A.沸点:H2Q>H2R
B.碱性:T(OH)3>M(OH)2
C.T和Q两者最高价氧化物对应的水化物可以发生反应
D.L与R形成的化合物中只能含有离子键
电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示。下列有关说法错误的是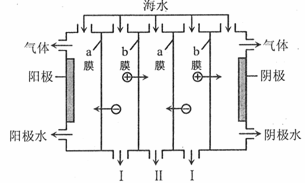
A.阳极可发生电极反应: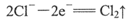 |
| B.阴极附近溶液的pH减小 |
| C.a膜为阴离子交换膜, b膜为阳离子交换膜 |
| D.I、II分别是淡水、浓海水出口 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.4gNaOH固体所含电子总数为2NA |
| B.22.4LC2H6所含化学键总数为7 NA |
| C.常温常压下,14gCO、N2混合气体所含分子总数为NA |
| D.0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
紫苏醇的结构简式如右图所示。下列有关紫苏醇的说法正确的是
| A.与乙醇互为同系物 |
| B.一定条件下能与乙酸发生酯化反应 |
| C.存在属于芳香族化合物的同分异构体 |
| D.能与溴水、酸性高锰酸钾溶液发生加成反应 |
化学与生活密切相关,下列说法正确的是
| A.铝制容器可长期盛放酸性或碱性物质 |
| B.甲烷会导致某些温泉有臭鸡蛋气味 |
| C.太阳能的开发利用可降低碳排放量 |
| D.塑料垃圾会造成水体富营养化 |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是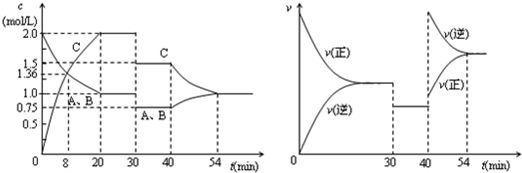
| A.30min时降低温度,40min时升高温度 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.8min前A的平均反应速率为0.08mol/(L•min) |
| D.30min~40min间该反应使用了催化剂 |