一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示。
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0g |
75.0g |
140.0g |
| 反应后 |
37.0g |
79.5g |
140.0g |

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.3CuSO4  3CuO + SO3↑ + 2SO2↑ + O2↑
3CuO + SO3↑ + 2SO2↑ + O2↑
B.4CuSO4  4CuO + 2SO3↑ + 2SO2↑ + O2↑
4CuO + 2SO3↑ + 2SO2↑ + O2↑
C.5CuSO4  5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
D.6CuSO4  6CuO + 4SO3↑ + 2SO2↑ + O2↑
6CuO + 4SO3↑ + 2SO2↑ + O2↑
下列叙述正确的是
| A.利用惰性电极电解饱和食盐水的过程中,溶液中水的电离平衡向左移动 |
| B.溴元素和碘元素被称为“海洋元素” |
| C.向AlCl3溶液中加入氨水可制取Al(OH)3 |
| D.Fe分别与氯气和稀盐酸反应可得到同一种氯化物 |
化学与生产、生活和科技关系密切,下列叙述错误的是
| A.手机上用的锂离子电池属于二次电池 |
| B.向海水中加净水剂明矾可以使海水淡化 |
| C.氮的固定是指空气中游离态氮转化为化合态的过程 |
| D.食盐水和淀粉溶液可以通过丁达尔现象实验进行鉴别 |
实验室用0.10mol/L的NaOH溶液滴定某一元弱酸HA的滴定曲线如图所示。图中横轴为滴入的NaOH溶液的体积V(mL),纵轴为溶液的pH。下列叙述不正确的是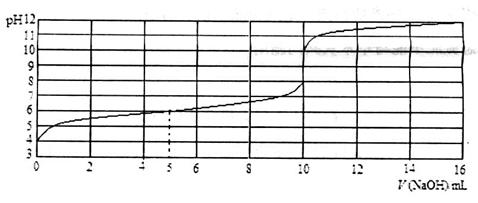
A.此一元弱酸HA的电离平衡常数Ka≈1×10-6mol/L
B.此弱酸的起始浓度约为1×10-2mol/L
C.此实验最好选用酚酞试液(变色范围8.0~10.0)做指示剂
D.当混合液pH=7时,溶液中c(HA)>c(A—)
关于下列各装置图的叙述中,正确的是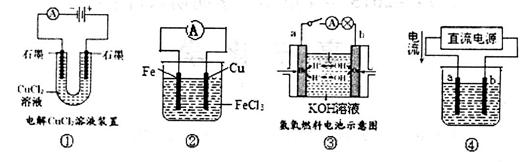
| A.装置①阳极有红色物质析出 |
| B.装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中a为负极,发生的电极反应式为H2+2OH-—2e-=2H2O |
| D.用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液 |
室温时,关于下列溶液的叙述正确的是
| A.1.0×10—3mol/L盐酸的pH=3,1.0×10—8mol/L盐酸的pH=8 |
| B.pH=a的醋酸溶液稀释l倍后,溶液的pH=b,则a>b |
| C.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7 |
| D.1mLpH=l的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |