为了探索外界条件对反应:aX(g)+bY(g)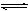 cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是( )
cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是( )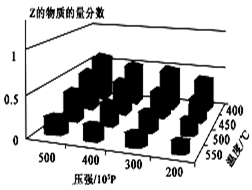
| A.△H<0, a+b>c | B.△H>0, a+b<c |
| C.△H>0, a+b>c | D.△H<0, a+b<c |
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1∶1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g) 
|
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成C的速率与C分解的速率相等汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是( )
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
已知下列元素的原子半径:
| 元素 |
N |
S |
O |
Si |
| 原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷元素的原子半径可能是( )
A.0.80×10-10m B.1.10×10-10 m
C.1.20×10-10 m D.0.70×10-10m
下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.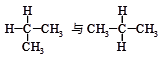 |
D.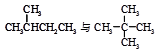 |