制备食用碘盐(KIO3)原理之一为:I2 +2KClO3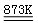 Cl2 +2KIO3,下列说法正确的是
Cl2 +2KIO3,下列说法正确的是
| A.KClO3和KIO3均属于离子化合物,只含有离子键 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl |
| C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气 |
| D.制备KIO3的反应中I2被氧化 |
2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+ Cl2(g) PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
| A.0.40 mol | B.小于0.20 mol |
| C.0.20 mol | D.大于0.20 mol,小于0.40 mol |
在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)增大的是
| A.加少量HNO3 | B.加少量KOH固体 |
| C.加少量(NH4)2SO4固体 | D.加大量水 |
一定条件下,达到平衡状态时的可逆反应2A(g) 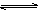 2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是
2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是
| A.增加A的物质的量 | B.减小A的物质的量 |
| C.升高体系的温度 | D.减小体系的压强 |
下列叙述正确的是
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2 mol•L-1的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 | B.水的离子积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 | D.水的离子积变大、pH变小、呈中性 |