铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。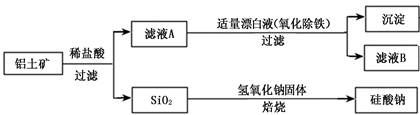
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
□Fe2++□ClO-+ =□Fe(OH)3↓+□C1-+
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
(2)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:2Al+3HO2-=2AlO2-+OH-+H2O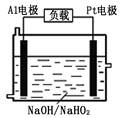
①正极反应式为 。
②Al电极易被NaOH溶液腐蚀,这是该电池目前未能推广使用的
原因之一,电极被腐蚀的离子方程式为 。
(3)钢材镀铝可以防止钢材腐蚀,在镀铝电解池中电解液采用熔融盐(成分NaCl、KCl,电镀时氯元素和铝元素主要以AlCl4-形式存在)。不采用氯化铝溶液的原因是 。
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。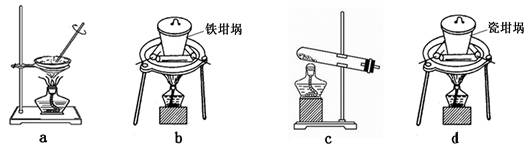
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
试回答下列问题:
(1)过滤用的器材已有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_______________。
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是_____________。
(3)从滤液E中得到绿矾晶体的实验操作是_______________________________。
(4)写出用滤渣F制备胆矾晶体的化学方程式_____________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理?________,理由是___________。
碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答如下问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+
(x+y)H2 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→()( )→()( )→()( )→()()→()( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g 残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为_____g,化学式为_____________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________________________________。
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计如图所示装置进行“铁与水反应”的实验。
(1)硬质玻璃管中发生反应的化学方程式为______________________________。
(2)反应前A中投放碎瓷片的目的是____________________________________。
(3)装置E中的现象是________________________________________________。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质玻璃管B冷却后,取少许其中的固体物质溶于_______后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为_______;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为_______。
①一定有Fe3O4②一定有Fe
③只有Fe3O4④只有Fe
(6)另一份用_______(填仪器名称)加入_______,可以证明溶液中存在Fe2+。
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。
(7)试剂b的化学式是_______。
(8)计算反应后B装置中铁元素的质量分数为_______。
一般测定样品中成分含量的实验应重复2~3次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙、丙三位同学分别设计了如下实验方案:
Ⅰ.甲同学的方案如图所示:
(1)如何检验A装置的气密性?_____________________________________________。
(2)甲同学重复进行了三次实验,得到碳酸钠的质量分数的数据存在较大的偏差,你认为可能引起测量结果偏低的原因是_______(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足、反应不充分
(3)为了让甲的实验测量结果更准确,在其他实验步骤都正确的条件下,你认为图中的实验装置应该如何改进:______________。
Ⅱ.乙同学的方案是:从图中所提供的装置中选择实验装置,代替甲同学实验装置中的B、C,通过测定放出的二氧化碳的体积(不考虑二氧化碳溶于水)来计算。
选择最简装置的连接顺序为_______。
Ⅲ.丙同学的方案是:称取样品m g,并溶解,加入过量氯化钡溶液,过滤、洗涤、烘干、称量,得固体n g。
(1)配制100 mL 0.10 mol/L BaCl2溶液的实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒外还有_______(填仪器名称)。
(2)混合物中碳酸钠的质量分数为(用m、n表示)_______。
(3)Ca2+、Ba2+都可以使 沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?_______ (填“能”或“否”),原因是:_____________________________________。
沉淀完全,能否使用氯化钙溶液代替氯化钡溶液?_______ (填“能”或“否”),原因是:_____________________________________。
如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
(1)该实验的实验目的是__________________________________________。
(2)在A试管内发生反应的化学方程式是_______________________________。
(3)B装置的作用是_________________________________________________。
(4)在双球干燥管内发生反应的化学方程式为____________________________。
(5)实验时观察到的实验现象是_______________________________________。
上述实验现象说明___________________________________________________。
(6)若将干燥管内的Na2O2换成Na2O,则实验时观察到的实验现象是___________。