运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
① CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) △H=-764.5kJ/mol
O2(g)=CO2(g)+2H2O(l) △H=-764.5kJ/mol
② CO(g)+ O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③ H2(g)+ O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
则CO(g)+2H2(g)=CH3OH(g) △H=__________kJ/mol
(2)下列措施中能够增大上述合成甲醇反应的速率的是_________(填写序号)。
a.使用高效催化剂
b.降低反应温度
c.增大体系压强
d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示 。
。
①P1_________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=_________(mol L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”、或“不变”)
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式__________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如右图所示。请写出开始时阳极反应的电极反应式____________。
小苏打、胃舒平都是常用的中和胃酸的药物。
(1)若小苏打每片含0.42gNaHCO3,则2片小苏打片和胃酸完全中和,被中和的氢离子是mol。
(2)若胃舒平每片含0.195gAl(OH)3,则中和胃酸时,6片小苏打片相当于胃舒平片。
火力发电在能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
(1)天然海水呈碱性,写出SO2与OH-反应的离子方程式:。
(2)天然海水吸收了含硫烟气后会溶有H2SO3分子,使用氧气将其氧化的化学原理是
(用化学方程式表示)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是。
某有机物A的结构简式为HOOC—CH==CH—CH2OH。
(1)请你写出该有机物官能团的名称:。
(2)验证该有机物中含有—COOH官能团常采用的方法,产生的现象为。
(3)写出下列反应的化学方程式,并注明反应类型。
①A和溴水反应反应类型:
②A和乙酸反应反应类型:
③A和乙醇反应反应类型:
下表为元素周期表的一部分,请回答有关问题:
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)①和⑤的元素符号是和。
(2)表中最活泼的金属是,非金属性最强的元素是。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是(填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式:,
。
(4)⑦和⑩元素形成单质的氧化性的强弱为。(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示)。
现有前四周期的地五种主族元素A、B、C、D、E,A的最高价氧化物含A40%,A原子质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成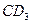 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
(1)五种元素的元素符号分别为
A、B、C、D、E、
(2)五种元素中,单质还原性最强的是,简单例子还原性最强的是
(3)A到E五种元素中最高价氧化物对应的水化物中,酸性最强的是碱性最强的是
(4)D单质与B的最高价氧化物对应的水化物的反应的离子方程式为
(5)B、C元素最高价氧化物的水化物之间的化学方程式为