亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
(1)吸收塔内发生反应的化学方程式为_____________________(配平化学方程式)。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为________克。
(2)从滤液中得到的NaClO2·3H2O晶体的操作依次是__________(填写序号)。
a.蒸馏 b.灼烧 c.过滤 d.冷却结晶
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为____________;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______________(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是_______;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时的S2-的浓度为____。
已知

无机化合物可根据其组成和性质进行分类,以下是一组对“一些物质与水反应”的分类图,请按要求填空.
(1)上述分类中,分成A、B两组的依据是.
(2)C组物质与水反应的离子方程式为.
(3)D组物质与水反应中,氧化剂和还原剂物质的量之比为1:1的物质有(填化学式).
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题: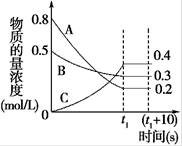
(1)该反应的化学方程式为。
(2)0~t1s 内B气体的平均反应速率为。
(3)(t1+10)s 时,A的转化率为,此时v(A)正v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为。
C、N、O、Al、Si、Cl、Fe是七种常见元素
(1)N元素位于周期表第周期,第族,C元素的一种同位素可测定文物年代,这种同位素的符号是。
(2)用“>”、“<”或“= ”填空:
| 离子半径 |
得电子能力 |
酸性 |
金属性 |
| O2―Al3+ |
16O18O |
H2CO3HNO3 |
FeAl |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为,电池负极反应的电极方程式为。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为
CH4(g)+H2O(g)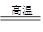 CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示: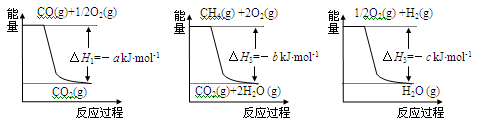
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t5min(填“>”、“<”或“=”,下同);乙容器达到平衡时N2的浓度c3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g) Ni(CO)4(g),△H
Ni(CO)4(g),△H
则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H________(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。