硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。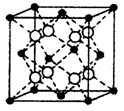
(10分,每空2分)水的电离平衡曲线如图所示。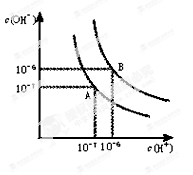
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将pH=8的NaOH溶液与pH=5的稀盐酸混合,并且保持100℃的恒温,欲使混合溶液pH=7,则NaOH与盐酸的体积比为。
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是。
(4)室温时,Mg(OH)2(S) Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。【已知25℃时Ksp[Mg(OH)2]=1.0×10-11】
Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。【已知25℃时Ksp[Mg(OH)2]=1.0×10-11】
(10分每空2分)室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生如下反应:N2+3H2 2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
(1)平衡时N2的物质的量为mol
(2)5min内用H2表示的反应速率为mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率(填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:
(5)写出该反应的平衡常数的表达式:
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,从海水制备金属镁的流程如下图所示:
(1)为了节约成本,充分利用滩涂资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:、。
(2)Mg(OH)2沉淀中混有的Ca(OH)2,可通过加入MgCl2溶液,充分搅拌,过滤,沉淀再用水洗涤而除去。写出反应的化学方程式:。
(3)写出电解熔融MgCl2制得金属镁的化学方程式。
氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。
(1)下列关于氮、硫、碳氧化物的叙述中,正确的是__________:
①氮的氧化物是形成酸雨的重要原因之一
②SO2具有漂白作用,可用来熏制鲜姜、辣椒,起到保鲜、增亮的作用
③NO在扩张血管、免疫、增强记忆等方面有重要作用
④NO2、CO都能跟血红蛋白结合而引起人体缺氧中毒
⑤氮氧化物与碳氢化合物经紫外线照射发生反应形成光化学烟雾。
(2)在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),可以使CO、NO反应生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式。工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式。
(3)你认为减少酸雨产生的途径可采用的措施是_____ ___(填代号)。
①少用煤作燃料
②把工厂烟囱造高
③燃料脱硫
④在已酸化的土壤中加石灰
⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(4)硫酸厂可用足量的烧碱来吸收SO2,其化学反应方程式为。
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1817、2745、11575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。