下列实验方案不能达到实验目的的是
| |
实验目的 |
实验方案 |
| A |
研究催化剂对过氧化氢分解速率的影响 |
分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一只试管中加入少量MnO2 |
| B |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C |
可以鉴别这两种溶液 |
将Na2CO3溶液与HCl溶液相互滴加 |
| D |
测定铝箔中氧化铝的含量 |
取a g铝箔与足量稀盐酸充分反应,将逸出的气体通过碱石灰后,测其体积为bL(标准状况下) |
下列反应中,不属于取代反应范畴的有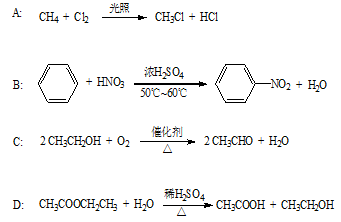
有关下列物质分子结构特征描述正确的是
| A.乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键 |
B. 表示苯分子的结构,因此能解释邻二甲苯有 表示苯分子的结构,因此能解释邻二甲苯有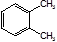 和 和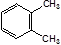 两种结构 两种结构 |
C.因为甲烷是一种正四面体结构,所以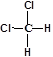 和 和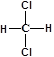 属于同一种物质 属于同一种物质 |
| D.苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色 |
由0.1mol两种气态烃组成的混合气体,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是
| A.混合气体中一定含有甲烷 | B.混合气体中一定是甲烷和乙烯 |
| C.混合气体中一定有乙烷 | D.混合气体中一定有乙炔 |
下列说法正确的是
| A.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 |
| B.两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 |
| C.油脂、淀粉、纤维素、蛋白质都是高分子化合物、 |
| D.医院用紫外线灯消毒的依据的原理是紫外线能使病毒蛋白质发生变性 |
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,则加入的试剂分别是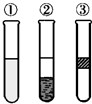
| A.①是酒精,②是CCl4,③是苯 |
| B.①是苯,②是CCl4,③是酒精 |
| C.①是CCl4,②是苯,③是酒精 |
| D.①是苯,②是酒精,③是CCl4 |