如图为酸雨的形成示意图,相关说法不正确的是
| A.HNO3、H2SO4均有腐蚀性 |
| B.酸雨的pH:5.6≤pH≤7 |
| C.汽车尾气中含NO |
| D.工业尾气中的SO2、NO2的应回收利用 |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的是()
| A.p(Ne)>p(H2)>p(O2) | B.p(O2)>p(Ne)>p(H2) |
| C.p(H2)>p(O2)>p(Ne) | D.p(H2)>p(Ne)>p(O2) |
下列叙述正确的是( )
| A.相同条件下,M2和O2的混合气体与等体积的N2所含原子数相等 |
| B.等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等 |
| C.常温常压下28 g CO与22.4 L O2所含分子数相等 |
D.16 g CH4与19 g 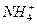 所含质子数相等 所含质子数相等 |
两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的()
| A.原子总数 | B.质子总数 |
| C.中子总数 | D.质量 |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量小 |
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:
2R(g)+5Q(g)====4X(g)+nY(g)
反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是()
| A.2 | B.3 | C.4 | D.5 |