硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 |
电离常数(298K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g)  2SO3(g) ΔH<0 2SO3(g) ΔH<0 |
B.4 NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
C.H2(g)+I2(g)  2HI(g) ΔH>0 2HI(g) ΔH>0 |
D.2 NH3(g) N2(g) +3H2(g) ΔH>0 N2(g) +3H2(g) ΔH>0 |
关于平衡常数,下列说法不正确的是
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数随压强的改变而改变 |
| D.使用催化剂不能使平衡常数增大 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
下列热化学方程式正确的是(△H的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g) △H=-269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO △H= +116.2kJ/mol(反应热) |
某绝热恒容容器中充入2mol/LNO2,发生反应2NO2 N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是
N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是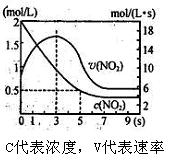
| A.5s 时NO2的转化率为75% |
| B.0 —3s 时v(NO2 )增大是由于体系温度升高 |
| C.3s 时化学反应处于平衡状态 |
| D.9s 时再充入N2 O4,平衡后平衡常数K 较第一次平衡时大 |