铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品: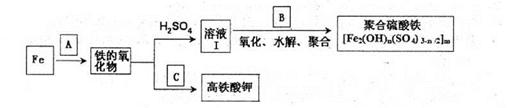
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-):____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+______。
在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图:
经测定某溶液中只含有Na+、CHCOO-、H+、OH-四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g)△H =" +131.3" kJ ,△S =" +133.7" J/K
H2(g) + CO(g)△H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发(填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是。
(3)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g) N2 (g)+ 3H2(g)的K=(填数值)。
N2 (g)+ 3H2(g)的K=(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1molN2、3molH2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是(填序号)。
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能:1>2 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
C |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是。(4)丁组实验所得混合溶液中由水电离出的c(OH-)=mol·L-1。写出该混合溶液中下列算式的精确结果(不能做近似计算): c(Na+)-c(A-)=mol·L-1, c(OH-)-c(HA)=mol·L-1。
在75℃左右,用HgSO4作催化剂,乙炔可水化为乙醛.但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图: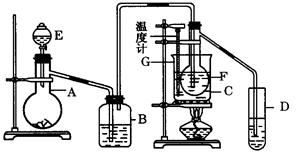
请回答以下问题:
(1) 实验开始时,仪器A中盛放电石,B中应装入,其作用是.
(2) 仪器D中盛放水,其作用是.
(3) 蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先
后顺序写出包括HgO在内的各试剂名称,将HgO加入F中的操作方法是.
(4) 装置图中,加热F的方式叫,所选用温度计G的量程表示正确的是__________(填代号).
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.0℃~360℃ |
(5) 检验乙醛已制出的操作、现象是.
已知有机分子中烯键可以在一定的条件下发生臭氧分解反应,例如: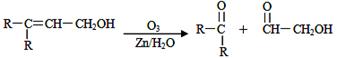 ,某有机物A的化学式是
,某有机物A的化学式是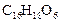 ,它可以在一定条件下合成一种感光性高分子材料,该材料在微电子工业上具有重要用途.
,它可以在一定条件下合成一种感光性高分子材料,该材料在微电子工业上具有重要用途.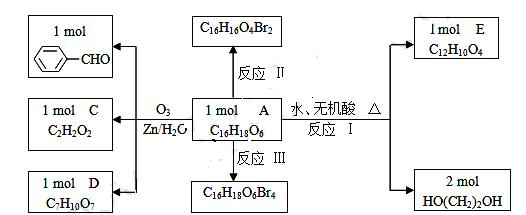
请回答:
(1) 指出下列反应的反应类型.反应II_____________;反应III_____________.
(2) 根据上述信息判断A中含有的官能团(或名称)______________________________.
(3) 写出下列物质的结构简式:C;D______________.
(4) 写出反应III的化学反应方程式(必须用结构简式表示):
____________________________________________________________________________