已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
| 0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X溶液 |
0.1mol·Lˉ1 双氧水 |
1 mol·L1 稀盐酸 |
|||
| 1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
| 2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
| 3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
| 4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。
(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)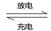 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是。
(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是。
②氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式。
②碱石灰的作用是。
③整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。
Ⅱ.3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为mol。
②所生成的NO在标准状况下体积为L。(以上结果均用含a的代数式表示)
Ⅲ.某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
(1)③中在煅烧过程中一定发生的反应的化学方程式为。
(2)关于固体甲的成分的判断中,下列说法正确的是
| A.固体甲中,CuS和Cu2S不能同时存在; |
| B.固体甲中,CuO和Cu2O至少有一种; |
| C.固体甲中若没有Cu2O,则一定有Cu2S; |
| D.固体甲中若存在Cu2O,也可能有Cu2S。 |
下图是病人输液用的葡萄糖(分子式为C6H12O6,相对分子质量为180)注射液的标签上的部分内容。
(1)该注射液中葡萄糖的质量分数是;葡萄糖的摩尔质量是;
(2)该注射液中葡萄糖的物质的量浓度是(小数点后保留两位);
(3)实验室配制250 mL该浓度的葡萄糖溶液需要用天平称取葡萄糖粉末g ,需要的主要玻璃仪器有量筒、烧杯、胶头滴管、、等。
(4)下列操作不正确的是(填序号)。
①使用容量瓶前检查它是否漏水
②定容时仰视刻度线
③定容时加水超过刻度线,把水倒出一些,重新加水至刻度线
④定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。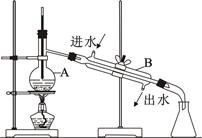
(1)图中的两处明显的错误是:
①;
②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水外,为防止液体暴沸还需加入少量。
(16分)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:
[实验探究]
(1)A中的反应(填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体(只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是L
(NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,
可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处
理装置,合适的装置是(填“F”或“G”)。
[知识拓展]
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
[知识应用]
(9)2010 年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民深夜大转移。假如你在现场,你会采用什么自救方法?
(4分)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中。
实验方法:A加热 B将溶液滴在pH试纸上 C溶解、过滤、结晶 D滴加KSCN溶液
| 实验目的 |
实验方法 |
| 检验氯化亚铁是否变质 |
|
| 除去食盐中少量细沙 |
|
| 除去碳酸钠固体中少量碳酸氢钠 |
|
| 证明某地雨水样品呈酸性 |