设NA为阿伏加德罗常数的值,下列说法正确的是
| A.1L0.5mol·L-1 的(NH4)2SO4溶液中含NH4+数为NA |
| B.常温常压下,1molCH4中含有4NA个C-H键 |
| C.常温常压下,48g O3含有原子数为2NA(相对原子质量:O 16) |
| D.标准状况下,22.4LC6H6(苯)的分子数目为NA |
化合物M叫假蜜环菌素,它是香豆素类天然化合物。对化合物M 的叙述错误的是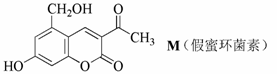
| A.M的分子式为C12H10O5 |
| B.1mol M最多可和6mol H2发生加成反应 |
| C.M可发生水解反应 |
| D.M可与 HBr反应 |
下列说法正确的是
| A.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B.Ⅵ族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P="3" P2O5+5KCl,则下列有关叙述错误的是
| A.上述反应是放热反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.该反应氧化剂与还原剂物质的量之比为6:5 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+1/2O2(g)ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是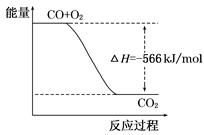
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO2(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
白磷与氧可发生如下反应:P4+5O2===P4O10.已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P==="O" c kJ/mol、O==="O" d kJ/mol.
根据右图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是
| A.(4c+12b-6a-5d) kJ/mol |
| B.(6a+5d-4c-12b) kJ/mol |
| C.(4c+12b-4a-5d) kJ/mol |
| D.(4a+5d-4c-12b) kJ/mol |