用作软质隐形眼镜材料的聚合物E是: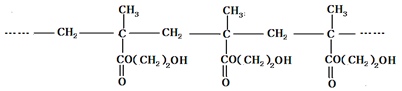
一种合成聚合物E的路线如下: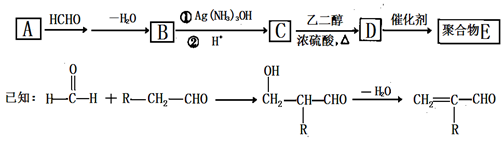
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是 ;
(2)B的分子式为 ;D中所含的官能团名称为
(3)D→E的反应类型是 反应;
(4)C有多种同分异构体,属于酯且含有碳碳双键的同分异构体共有5种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式 ;
(5)写出由乙烯合成乙二醇的化学方程式。
、 。
【化学-选修5有机化学基础】咖啡酸苯乙酯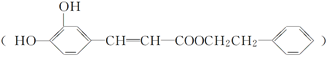 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。
请回答下列问题:
(1)A分子中的官能团是_______________________________。
(2)高分子化合物M的结构简式是_______________________________。
(3)写出A→B反应的化学方程式:__________________________________。
(4)A→B的反应类型为__________;E→M的反应类型为________;B→C的反应类型为__________。
(5)A的同分异构体有很多种,其中同时符合下列条件的同分异构体有________种。
①苯环上只有两个取代基
②能发生银镜反应
③能与碳酸氢钠溶液反应
④能与氯化铁溶液发生显色反应
药物普仑司特对预防和治疗中耳炎、银屑病等均有良好疗效。在普仑司特的合成中需要用到关键中间体M(1﹣溴﹣4﹣苯丁烷)。中间体M的合成路线如下:
已知:
回答下列问题:
(1)D中的官能团为 ;反应④属于 反应(填反应类型);
B的结构简式为 。
(2)写出一种满足下列条件的A的同分异构体的结构简式: 。
A.能发生银镜反应和水解反应:
B.不存在顺反异构体
(3)利用溴代烃E(含溴质量分数为66.1%)为起始原料也可制得中间体M:
则E的结构简式为
F→M的化学方程式为 。
(4)C6H5MgBr与化合物G在一定条件下直接反应可制得M。①用系统命名法给化合物G命名: ;②写出加热条件下G在足量NaOH醇溶液中反应的化学方程式: 。
长托宁是一种选择性抗胆碱药,可通过以下方法合成(部分反应条件略去):
(1)长托宁中的含氧官能团为_________和_________(填名称)
(2)反应②中加入试剂X的分子式为C8H6O3 ,X的结构简式为_________
(3)反应③的反应类型为_______________
(4)S的同分异构体满足下列条件:
①能与FeCl3溶液发生显色反应。
②核磁共振氢谱有5个峰且峰的面积比为2:4:4:1:1;分子中含有两个苯环。写出该同分异构体的结构简式_________________
(5)根据已有知识并结合相关信息,写出以 和
和 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如图所示,则下列有关说法正确的是______。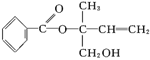
| A.X在一定条件下能发生加成反应、加聚反应和取代反应 |
| B.在Ni催化下,1molX最多只能与1molH2加成 |
| C.可用酸性高锰酸钾溶液区分苯和X |
| D.X核磁共振氢谱有10个吸收峰 |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得: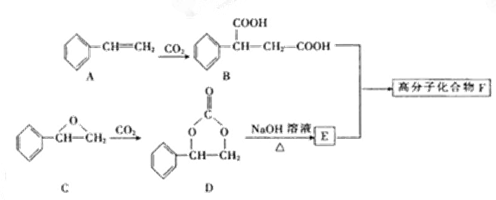
化合物B分子式为 ,1mol化合物B完全燃烧需要消耗 mol O2 。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,但只有Ⅰ能与Na反应产生H2,则化合物Ⅰ的结构简式为 (任写一种);由化合物Ⅱ生成A的反应条件为 。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式: 。
(5)化合物Ⅲ的结构简式为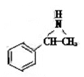 在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
【改编】Heck反应是偶联反应的一种,例如:反应①: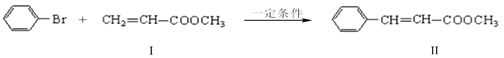
化合物Ⅰ可以由以下途径合成: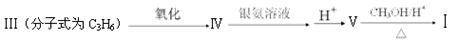
(1)下列关于化合物Ⅱ的说法正确的是 。
| A.化合物Ⅱ存在顺反异构 |
| B.化合物Ⅱ的分子式为C10H8O2 |
| C.分子中含有两种官能团 |
| D.1mol化合物Ⅱ最多与5mol氢气发生加成反应 |
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,则检验CH3CHBrCH3中官能团的试剂是 (写名称)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ与新制氢氧化铜悬浊液反应的化学方程式为: 。
(4)符合下列条件的化合物Ⅱ的同分异构体有____种;
①苯环上只有两个取代基;
②能发生银镜反应,1mol该化合物最多产生4mol银;
③分子中不存在甲基
其中核磁共振氢谱只有三组峰,峰面积之比为1:2:2的结构简式为_________。
(5)一定条件下,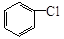 与
与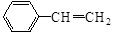 也可以发生类似反应①的反应,其有机产物的结构简式为: 。
也可以发生类似反应①的反应,其有机产物的结构简式为: 。