某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是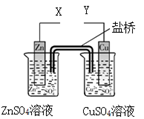
| A.X和Y与电流表连接,电子由Cu极流向Zn极 |
| B.X和Y与电流表连接,将Zn换成Fe测得电流更大 |
| C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻 |
| D.X和Y分别与电源“—”、“+”极相连,Zn极质量减轻 |
可以用分液漏斗分离的一组混合物是
| A.酒精和碘 | B.苯和水 | C.乙酸和水 | D.溴和四氯化碳 |
下列关于蛋白质的叙述正确的是
| A.天然蛋白质的组成元素只有磷、氢、氧、氮 |
| B.加热会使蛋白质变性,因此食生鸡蛋的营养价值更高 |
| C.向鸡蛋中加食盐,会使蛋白质凝固变性 |
| D.用一束光照射蛋白质溶液,可以产生丁达尔现象 |
下列关于乙烯和聚乙烯的叙述不正确的是
| A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 |
| B.乙烯的化学性质比聚乙烯活泼 |
| C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D.取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等 |
下列说法正确的是
①11H、21H、31H为三种不同的核素②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体④11H、21H、31H同系物⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
铝能用来冶炼难熔金属(如Fe 、V、Mn等),这是因为铝有
| A.两性 | B.良好导电性 |
| C.熔点低 | D.还原性,在反应中放出大量热 |