兔耳草醛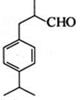 是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示:
是一种重要的香料。用有机物I为原料可以合成兔耳草醛,其合成路线如图所示: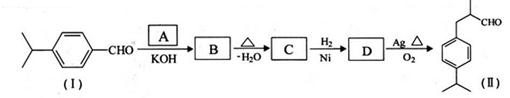
已知:
试回答下列问题:
(1)兔耳草醛的分子式是 ,物质A的结构简式是 ;
(2)检验C中含有的碳碳双键所用试剂是 (单选);
| A.酸性KMnO4溶液 | B.新制备Cu(OH)2悬溶液 | C.溴水 | D.溴的CCl4溶液 |
(3)C→D的反应类型是: ,其反应的化学方程式为:
(注明反应条件);
(4)兔耳草醛中的含氧官能团易被氧化,生成化合物W,化合物W的结构简式是 。
(5)有机物I有多种同分异构体,其中一类同分异构体能使FeCl3溶液显紫色,结构中不含—CH3,且苯环上只有两个互为对位的取代基,其可能的结构简式为 (写出一种)。
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
其中A、B、C均为链状化合物,A能发生银镜反应,B中不含甲基。请回答下列问题:
(1)A、B的结构简式分别为、。
(2)C中是否含有手性碳原子。(填“含有”或“不含有”)
(3)写出一种满足下列条件的A的同系物的结构简式。
①分子式为C4H6O②含有1个-CH3
(4)1 mol C可与足量钠反应生成L H2(标准状况)。
(5)由物质C与D反应生成PTT的化学方程式为,反应类型为。
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去)。
请回答:
(1)E的化学式为____________;甲的原子结构示意图为____________;
(2)反应①的离子方程式为____________________________________;
反应②的化学方程式为____________________________________;
(3)实验室制取并收集B的操作中,用____________法收集B,验证B已收集满的方法是_______________________________________________(限答一种)。
(4)实验室制备丁的方程式为____________________________________,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示)______________________。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,实验小组利用A制备Al(OH)3的操作流程如下:
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是 ,该实验操作所用到的玻璃仪器有 。
(2)根据上述流程,写出D、E所含物质的化学式:
沉淀D ;溶液E 、 。
(3)写出②、③反应的离子方程式:
② ;③ ;
(10分)如下图中A~J分别代表有关反应中的一种中学化学常见单质或化合物,其中B、C、D、I均为无色气体,G为白色沉淀。(部分产物和反应条件已略去)
(1)若A加热后得到等物质的量的B和C,则A的化学式为 。
(2)实验室检验B的方法是 。
(3)写出上述由I生成J的化学方程式: 。
(4)写出C和少量Na[Al(OH)4]溶液反应的离子方程式: 。
(5)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择 (填代号)。
A.石灰石
B.稀硝酸
C.稀硫酸
D.稀盐酸
E.纯碱
所需气体发生装置是 (填代号);所选装置中涉及的玻璃仪器的名称为______。
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题: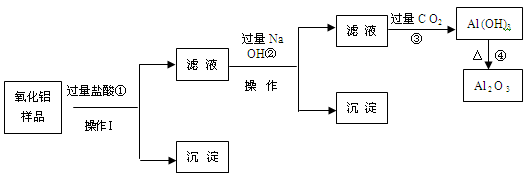
(1)沉淀A的成分是 (填化学式),沉淀B的成分是 (填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为:
、 ;
(3)在操作Ⅰ的名称是 ,其中玻璃棒的作用是 。