把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。在下列因素中对产生H2速率有影响的是( )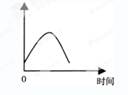
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
| A.①④ | B.③④ | C.①②③ | D.②③ |
向某盐溶液中滴加Ba(NO3)2溶液和过量的稀盐酸,有白色沉淀生成, 则原溶液可能是()
| A.KNO3溶液 | B.CaCl2溶液 | C.Na2SO3溶液 | D.Na2CO3溶液 |
为了更好的预防甲流,我校卫生科给全校每个班都配备了各种消毒液,其中有一种叫“84”消毒液,值日生在进行教室消毒时发现该消毒液是无色,而且具有漂白作用。那么它的有效成分是下列物质的哪一种()
| A.NaOH | B.NaClO | C.KMnO4 | D.Na2O2 |
下列关于浓硝酸和浓硫酸的叙述,正确的是( )
| A.常温下都用铜容器贮存 | B.露置在空气中,容器内酸液的质量都减轻 |
C.常 温下都能与铜较快反应 温下都能与铜较快反应 |
D.露置在空气中,容器内酸液的浓度都降低 |
某化学兴趣小组把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀A生成。再过滤,加热至恒重得到B。对物质A、B该小组有如下四种判断,你认为正确的是()
A. Fe(OH)3; Fe2O3 B. Fe(OH)2; FeO
C. Fe(OH)3、Fe(OH)2;Fe3O4D. Fe2O3;Fe(OH)3
硅被誉为无机非金属材料的主角,下列物品用到硅单质的是( )
| A.光导纤维 | B.计算机芯片 | C.水晶镜片 | D.石英钟表 |