设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)
| A.2.24L NO2含有0.2nA个氧原子 |
| B.常温常压下,C2H4和C3H6组成的28g混合气体中含4nA个氢原子 |
| C.1 molC2H6分子中含有7nA个极性键 |
| D.常温下pH=13的NaOH溶液中含有的0.1 nA个OH- |
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是()
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径 |
0.160 nm |
0.143 nm |
0.112 nm |
0.104 nm |
0.066 nm |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是()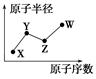
| A.Y、W的最简单氢化物的水溶液都呈酸性 |
| B.X、Y与Z中的任意两种元素均可形成两种或两种以上的化合物 |
| C.上述四种元素形成的化合物都抑制水的电离 |
| D.W的单质可从Z的最简单氢化物中置换出Z的单质 |
X、Y、Z是三种短周期金属元素,原子序数依次增大,单质的物质的量分别为n(X)、n(Y)、n(Z),它们与足量盐酸反应产生的氢气体积(标准状况下)为V(H2)X、V(H2)Y、V(H2)Z,且n(X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。下列说法正确的是()
| A.X、Y、Z一定处于同一周期 |
| B.X可能是镁 |
| C.Y和Z的最高价氧化物对应的水化物在一定条件下能反应 |
| D.工业上冶炼X、Y、Z通常是用热还原法制得 |
现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。在化合物中,这四种元素常见化合价均不止一种,但有一种相同的化合价。其部分性质如下:
| 元素 |
A |
B |
C |
D |
| 原子半径/nm |
0.102 |
0.077 |
0.117 |
0.075 |
| 最高正价或最低负价 |
+6 |
-4 |
+4 |
-3 |
下列说法错误的是()
A.四种元素在化合物中具有一种相同的化合价,即+4
B.高温下B可从C的氧化物中置换出C的单质
C.四种元素的最高价含氧酸均为强酸
D.只由非金属元素组成且含D元素的化合物中可能含有离子键
如图所示是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元系符号。已知X
位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是()
| A.原子半径X<Y |
| B.最高价氧化物对应的水化物酸性X>Y |
| C.X的氢化物具有强还原性 |
| D.Y与碘同周期,Y的最高价氧化物对应的水化物的酸性比高碘酸(HIO4)强 |