I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| |
Fe2O3 |
CO |
Fe |
CO2 |
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
4 |
3∶1 |
实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② |
378 |
4 |
4∶1 |
|
| ③ |
378 |
3 |
_______ |
|
| ④ |
398 |
4 |
4∶1 |
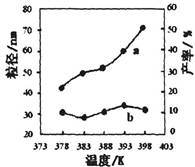
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份:①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。下列说法正确的是
| A.V1=V3>V2 | B.V2>V1 =V3 | C.V1= V2>V3 | D.V1>V3>V2 |
某金属M的氢氧化物的水合晶体[M(OH)2•xH2O]与Na2CO3混合物共36.800g,加入足量的水后,生成MCO3的白色沉淀,将沉淀滤出,洗净烘干,其质量为9.850g。
47. 将 9.850g MCO3高温灼热至恒重,得到7.650g MO固体,则产生CO2气体_______mol。
48.滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况),滤液中OH‑的物质的量为_______mol。
49.M的相对原子质量为_________;试通过计算确定M(OH)2•xH2O中x的值:
(12分)接触法制硫酸采用V2O5作催化剂,使用过的催化剂中含V2O5、VOSO4和SiO2,其中VOSO4能溶于水,从使用过的V2O5催化剂中回收V2O5的主要步骤是:向使用过的催化剂中加硫酸和Na2SO3浸取还原,过滤得VOSO4溶液;向滤液中加入KClO3氧化,再加入氨水生成沉淀;将沉淀焙烧处理后得V2O5。
(1) V2O5被浸取还原的反应产物之一是VOSO4,该反应的化学方程式为____。
(2) 若生产过程使用的硫酸用量过大,进一步处理时会增加________的用量。氨气常用________检验,现象是________________________。
(3) 若取加入氨水后生成的沉淀(其摩尔质量为598 g·mol-1,且仅含有四种元素)59.8 g充分焙烧,得到固体残留物54.6 g,同时将产生的气体通过足量碱石灰,气体减少了1.8 g,剩余的气体再通入稀硫酸则被完全吸收。通过计算确定沉淀的化学式(写出计算过程)。
常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
① V值范围;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。