发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成;
假设2:由小苏打和明矾组成;
假设3:由________________组成。
【方案与流程】
为探究某品牌的发酵粉的化学成分,某同学设计如下实验,得到如下现象: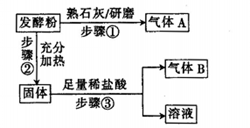
(2)该发酵粉的成分为________ (填化学式)。
(3)另一品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证,写出实验步骤、预期现象和结论。
| 实验步骤 |
 预期现象结论 预期现象结论 |
| 1.取少量样品溶于稀盐酸后,将溶液分成两份 |
|
| 2. _______________________________________ |
|
| 3. ________________________________________ |
|
(4)另一品牌的发酵粉的化学组成为小苏打和碳酸氢铵,为探究其化学式[化学式可表示为nNaHCO3·m NH4HCO3],称取4.05 g该产品在烧杯中溶解后,移入________配成100 mL溶液,用移液管取25.00mL溶液,滴加足量盐酸,生成的气体通入过量澄清石灰水中,生成的白色沉淀经干燥,称量为1.25 g。则该发酵粉的化学式为 。
(相对分子质量:NaHCO3:84 NH4HCO3:79 CaCO3:100)
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是__________________________________________.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图.
分析上图能够得出的实验结论是.
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。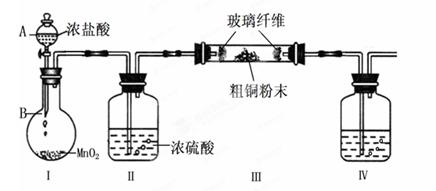 ③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④装置Ⅳ中盛装的试剂是,其作用是。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
① 上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
②现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
a.b.。
海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:(已知C12+2KI=2KCl+I2)
(1)指出提取碘的过程中有关的实验操作名称:①,③。
(2)提取碘的过程中,可供选择的有机试剂是()
A.苯、酒精 B.CCl4、苯 C.汽油、酒精
(3)为使海带灰中碘离子转化为碘的有机溶液,实验室里的烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,仍缺少的玻璃仪器
_________________________。
将所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,可以得到汽油和煤油。煤油。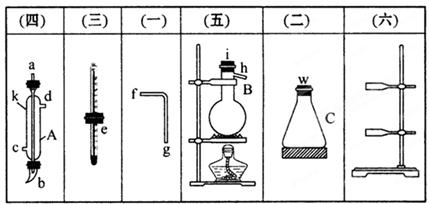
(1)图中A、B、C三种仪器的名称是________、________、________。
(2)A仪器中c是________,d是________。
(3)蒸馏时,温度计的水银球的位置应在____________________________________________。
(4)在B中注入原油后,加入几片碎瓷片的目的是__________________________________。
(1)分离沸点不同但又互溶的液体混合物,常用的方法是;分离固液混合物的常用的方法是;萃取剂的选择条件是
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答:。