工业合成氨的反应为:N2(g)+3H2(g)  2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。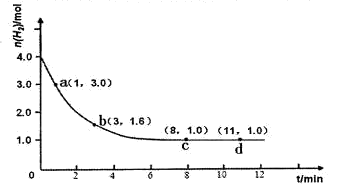
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随
反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得: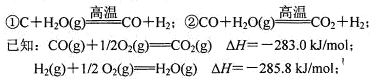
写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO其反应为:CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]•CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]•CO △H<0。写出提高CO吸收率的其中一项措施: 。
某C、H、O化合物,其分子量不超过180,所含碳、氧质量比为3:1。该有机物4.5g与新配制的Cu(OH)2反应可得Cu2O 9.0g,求它的分子式。
有两种饱和一元醛,其分子中碳原子数相差1,取混合液5.1g与足量的硝酸银氨溶液反应析出银21.6g,试确定两者的分子式。
A、B是分子量不相等的两种有机化合物,无论A、B以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生的水的质量也不变。试写出两组符合上述条件的分子式,并回答A、B应满足什么条件。
某C、H、O化合物0.05mol在0.2mol氧气中燃烧。氧气反应完后,此有机物亦已全部变成气态无机物(110℃)。生成的混合物平均分子量为27.0。将气态混合物通过盛有碱石灰的干燥管,干燥管增重8g。若改将气态混合物通过足量的澄清石灰水,则产生沉淀10g。求此有机物的分子式。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式为?