某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作I为_______。操作II用到的玻璃仪器有烧杯_______
(2)操作II、操作III的主要目的是_______、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3、Cu4((OH)6SO4均难溶于水,可溶于酸;分解温度依次为 80℃、200℃、300℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2mol•L-1HCl、1 mol•L-1H2SO4、0.1 mol•L-1NaOH、0.1 mol•L-1 BaCl2、蒸馏水。仪器和用品自选。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,_______________________________________________________________ |
说明悬浊液中混__________________________________________,有Cu4( OH)6SO4。 |
| 步骤2:另取少量悬浊液于试管中,____________________________ |
______________, 说明悬浊液中混有Cu( OH) 2。 |
(4)上述实验需要100mL 0.5 mol•L-1的CuSO4溶液,配制时需称取_______gCuSO4•5H2O (化学式量:250)。
下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中使用前需要检验是否漏液的是________ (填写编号);
(2)能够用以精确量取液体体积的是(填写编号);
(3)由于下列错误操作,使得到的数据比正确数据偏小的是__________(填写编号);
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面读数
C.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
(4)托盘天平精确度为g,称取 10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为g。
用下图所示装置进行实验,将A逐滴加入B中:
(1)若B为CaCO3,C为C6H5ONa溶液,实验观察到小试管内溶液变浑浊,则酸A比碳酸的酸性_________(填强、弱)。然后往烧杯中加入沸水,可观察到试管C中的现象是____________。
(2)若A是浓氨水,B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后向烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则C是葡萄糖与____________(写化学式)的混合液,该银镜反应的化学方程式为__________________,仪器D在此实验中的作用是_____________。
以下是某学习小组对乙二酸的某些性质进行研究性学习的过程:
[研究课题]探究乙二酸的某些性质
[查阅资料]乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
| 名称 |
乙二酸 |
乙二酸晶体 |
| 分子式 |
H2C2O4 |
H2C2O4·2H2O |
| 颜色状态 |
无色固体 |
无色晶体 |
| 溶解度(g) |
8.6(20℃) |
— |
| 熔点(℃) |
189.5 |
101.5 |
| 密度(g·cm-3) |
1.900 |
1.650 |
又知:
草酸在100℃时开始升华,157℃时大量升华,并开始分解。
草酸钙不溶于水。
草酸蒸气能使澄清石灰水变浑浊。
草酸蒸气在低温下可冷凝为固体。
根据上述材料提供的信息,回答下列问题:
[提出猜想]
(猜想一)根据草酸晶体的组成对其分解产物进行猜想
设计方案:
(1)该小组同学猜想其产物为CO、CO2和H2O,请用下列装置组成一套探究实验装置(草酸晶体分解装置略,装置可重复使用,连接导管略去)。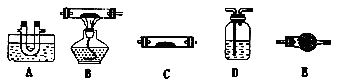
A中水槽装冰水混合物、B中装氧化铜、C中装无水硫酸铜,D中装澄清石灰水、E中装碱石灰
请回答下列问题:
①装置的连接顺序为:A→_____________________________________________。
②检验产物中CO的实验现象是____________________________________________________________
③整套装置是否存在不合理之处,(填是或否),若有该如何解决___________________________________________________________________________
(猜想二)乙二酸具有弱酸性
设计方案:
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是______(填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
(猜想三)乙二酸具有还原性
设计方案:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
___MnO4-+___H2C2O4 +___H+ ===___Mn2+ +___CO2↑+___H2O
(4)利用上述原理可定量测定某草酸晶体样品(含有H2C2O4·2H2O及其它一些杂质)中H2C2O4·2H2O的含量。
方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示(单位:mL),则该草酸晶体样品中H2C2O4·2H2O的质量分数为_____________。
(已知相对原子质量:Mr(H2C2O4·2H2O)=126)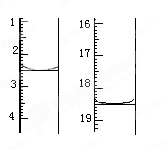
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: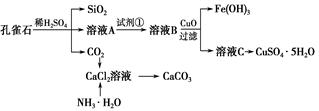
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是___________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________(填代号)装置回收。
(18分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)乙醇、乙酸分子中的官能团分别是、
(2)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(3)该反应属于哪类反应类型。
| A.加成反应 | B.取代反应 |
| C.水解反应 | D.酯化反应 |
E.可逆反应
(4)写出制取乙酸乙酯的化学反应方程式
。
(5)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸?
。
(6)乙醇在一定条件下还能发生脱水反应产生乙烯。乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 。
此外,乙烯能用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
工艺二: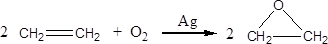
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,因此,在实际生产中,应采用(填“工艺一”或“工艺二”)更环保、更经济。