Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是
| A.AgO/Ag电极是负极 |
| B.当电极上析出1.08 g Ag时,电路中转移的电子为0.02mol |
| C.Al电极的反应式为:Al—3e-+4OH-= AlO2-+2H2O |
| D.在电解质溶液中OH-由Al电极移向AgO/Ag电极 |
某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能的是
| A.m>2x+2 | B.m=2x+2 | C.x︰m︰n=1︰2︰1 | D.m︰n=2︰1 |
关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,主要反应为:Ur-+Na+ NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
| A.正反应是吸热反应 | B.正反应是放热反应 |
| C.升高温度平衡向正反应方向移动 | D.以上说法都不正确 |
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,其中,你认为不正确的是
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
某反应2AB(g)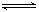 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
| A.ΔH<0,ΔS>0 | B.ΔH <0,ΔS<0 |
| C.ΔH>0,ΔS>0 | D.ΔH>0,ΔS<0 |
某温度下,反应N2O4(g) 2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是()
2NO2(g)△H>0,在密闭容器中达到平衡。下列说法不正确的是()
| A.加压时(体积变小),将使正反应速率增大 |
| B.保持体积不变,升高温度,再达平衡时颜色变深 |
| C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 |
| D.保持体积不变,加入少许NO2,将使正反应速率减小 |