不久前,一则“食用撒了鱼浮灵的鱼虾可能致癌”的微博在网上热传。“鱼浮灵”的化学成分实为过碳酸钠,使用不当会让鱼损伤,过碳酸钠本身无毒无害,对人体不会有危害。过碳酸钠,俗称固体双氧水,化学式为2Na2CO3·3H2O2,是一种无机盐,是白色颗粒状粉末,可以分解为碳酸钠和过氧化氢。某探究小组制备过碳酸钠并测定样品中H2O2的含量,其制备流程和装置示意图如下:
已知:50 °C时 2Na2CO3·3H2O2 (s) 开始分解
主反应 2Na2CO3 (aq) + 3H2O2 (aq) 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 = 3K2SO4 + 6MnSO4+10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
根据以上信息回答下列问题:
(1)推测图中支管的作用可能是 。
(2)步骤①的关键是控制温度,结合装置图归纳其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的是 。
(5)测定样品中H2O2的质量分数的方法是:准确称取0.2000g过碳酸钠样品于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.000 mol·L-1 H2SO4 (H2SO4过量),用0.002000mol·L-1 KMnO4标准溶液滴定至终点时消耗30.00 mL。
①滴定前,滴定管需用KMnO4标准溶液润洗2~3次,润洗的操作方法是:关闭酸式滴定管活塞,向滴定管中注入少量KMnO4标准 。
②上述样品中H2O2的质量分数计算表达式为 (只列出算式,不作任何运算!H2O2的式量为34.00)。
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和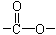 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯(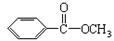 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| 熔点 ℃ |
沸点 ℃ |
水溶性 |
|
| 甲醇 |
—97.8 |
64.7 |
易溶 |
| 苯甲酸(一元弱酸) |
122.4 |
249.3 |
常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 |
—12.3 |
198 |
难溶 |
合成苯甲酸甲酯的流程如下:
请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。

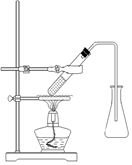
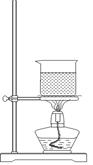
A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物②含有醛基③能与金属Na反应
某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题: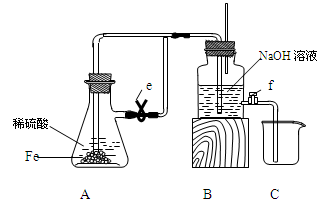
(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为:______________,试剂瓶B中可以观察到的现象是_____________________。
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是____,B中反应的离子方程式是_____________。
(3)如果开启活塞f放掉约2/3液体,此时试剂瓶B中可能出现的现象是____________________,B中反应的化学方程式是_____________________。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。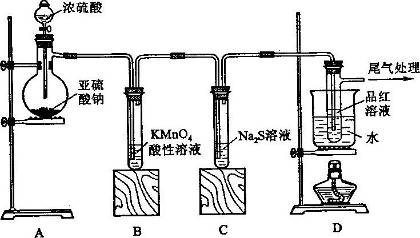
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式_______________________;
(2)实验过程中,装置B、C中发生的现象分别是____________、___________,装置B中发生反应的离子方程式为_________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________;
(4)尾气可采用___________________溶液吸收。
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收
K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下: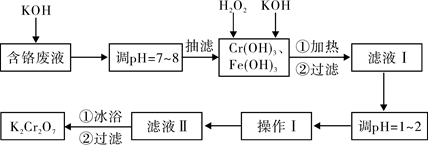
已知:①Cr(OH)3+OH-=CrO2-+2H2O;
②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250mL 6 mol·L-1 的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有。
(2)由于含铬废液中含有少量的K2Cr2O7,抽滤时可用代替布氏漏斗;抽滤过程
中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为。
(3)滤液Ⅰ酸化前,进行加热的目的是。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是。
(4)下表是相关物质的溶解度数据:
| 物质 |
0℃ |
20℃ |
40℃ |
60℃ |
80℃ |
100℃ |
| KCl |
28.0 |
34.2 |
40.1 |
45.8 |
51.3 |
56.3 |
| K2SO4 |
7.4 |
11.1 |
14.8 |
18.2 |
21.4 |
24.1 |
| K2Cr2O7 |
4.7 |
12.3 |
26.3 |
45.6 |
73.0 |
102.0 |
| KNO3 |
13.9 |
31.6 |
61.3 |
106 |
167 |
246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①、②。
(5)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为(设整个过程中其它杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将:(填“偏高”、“偏低”或“不变”)。
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。以铁屑为原料的制备流程如下: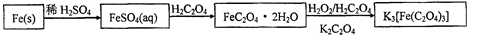
请回答下列问题:
(1)铁屑中常含硫元素,加稀硫酸时会产生有毒的H2S气体,可用氢氧化钠溶液吸收,下列吸收装置正确的是。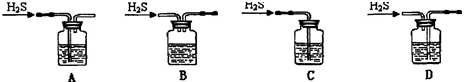
(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是(按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)该晶体盐在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验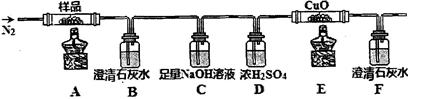
装置检查气密性后,先通一段时间N2,其目的为。结束实验时先熄灭酒精灯再通入N2至常温,其目的为。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则气体产物是。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列三种实验方案对该样品进行物质含量测定。
【甲】
【乙】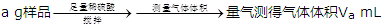
【丙】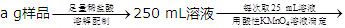 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中无法确定样品的组成,理由是。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中无法确定样品的组成,理由是。