现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/LHNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3; 假设二:固体全部是Na2SO4;
假设三: 。
(2)设计实验方案(略);选用下图装置进行实验,该装置的优点是 。
(3)进行实验:请在下表中用简要文字写出实验操作、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量固体样品于微型试管中;在W管a处滴入 、b处滴入 ;用胶管将W管与微型试管连接好 |
|
| 步骤2:用针筒吸入 ,将针头穿过微型试管的胶塞,向固体样品中注入该溶液。 |
。 |
| 步骤3:拨出针筒,吸入蒸馏水洗净;再吸入 注入微型试管中 |
。 |
(4)若将上述探究过程中生成的气体通入到足量的新制漂白粉浓溶液中,则可生成白色沉淀。试写出该反应的离子方程式: 。
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。反应一段时间后,停止加热。回答下列问题: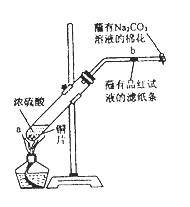
(1)写出a处反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为。待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)待试管中的液体冷却后,将试管上层液体倒去,再将剩余物质慢慢加入水中,可观察溶液呈色。
(4)玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花所起的作用是,反应的化学方程式为。
(5)若用浓度为18 mol/L的浓硫酸100 mL与过量的铜片,加热使之反应,则被还原的硫酸(选填“大于”、“等于”或“小于”)0.9 mol 。
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。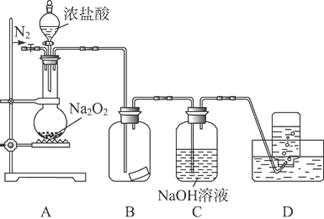
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因________________。
(2)装置C的作用是_________________________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①_________________________________________________________________;
②________。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。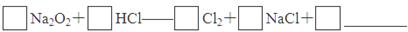
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是___________________________________________________________________________________________________________________________________(要求答出要点)。
证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。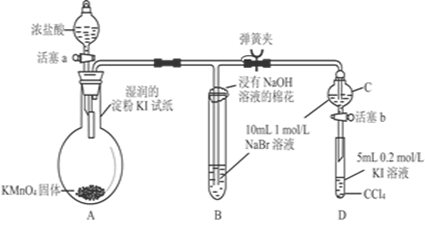
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是______________________________。
(2)B中溶液发生反应的离子方程式是______________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是________________________________________。
(4)过程Ⅲ实验的目的是__________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐,得电子能力逐渐______。
某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)他们决定用燃烧乙醇分析产物来确定乙醇中含有C、H两种元素。简要说明他们的具体操作:①证明含有氢元素的操作是_________________________________________________________
________________________________________________________________________________________;
②证明含有碳元素的操作是________________________________________________
_______________________________________________________________________
(2)要用燃烧分析产物证实乙醇中还含有氧元素时,需取得一些实验数据,这些数据应该是________________________。
(3)为确定乙醇的分子式,除(2)中数据外,还需不需要测定乙醇的相对分子质量?
_______________________________________________________________________
(4)为测定乙醇分子结构,他们用了无水乙醇和金属钠反应收集生成氢气的方法,选用了如下图所示的仪器(有的仪器配用双孔橡皮塞)。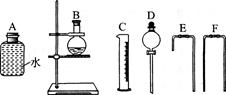
①装置的连接顺序是______接______接______接______接_______接_______。
②已知无水酒精的密度为0.789 g·cm一3,移取2.0mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为_______,由此可确定乙醇的结构为______________________而不是______________。
(5)实验所测定的结果偏高,可能引起的原因是(填写编号)。______________
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠反应不够完全
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有______
_________________________________________________________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有________。