对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )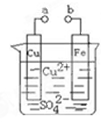
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是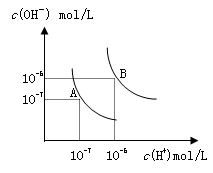
| A.纯水中25℃时的c(H+)比100℃时的c(H+)大 |
| B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3 |
| C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1 |
| D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1 |
常温下,下列叙述正确的是( )
| A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的C(H+)之比为1:1 |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7 |
| D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
下列化合物中,既能由单质直接化合制得,又能由复分解反应制得的是( )
| A.CuS | B.FeS | C.Al2S3 | D.FeCl2 |