如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是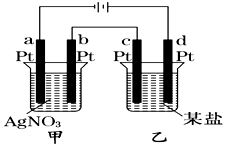
| A.甲池b极上析出金属银,乙池c极上析出某金属 |
| B.甲池a极上析出金属银,乙池d极上析出某金属 |
| C.某盐溶液可能是CuSO4溶液 |
| D.某盐溶液可能是Mg(NO3)2溶液 |
下列四组物质中,前者属于电解质,后者属于非电解质的是
| A.二氧化碳碳酸钠 | B.硫酸钠乙醇 |
| C.氧化铝硫 | D.蔗糖氢氧化钠 |
下列离子方程式书写错误的是
| A.硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓ |
| B.石灰石溶于盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.碳酸氢钠溶液与硝酸反应:HCO3-+H+=H2O+CO2↑ |
| D.氧化铁与稀硫酸反应:Fe2O3+6H+=2Fe3++3H2O |
要除去FeCl3溶液中的少量氯化亚铁。可行的办法是
| A.滴人KSCN溶液 | B.加入氯水 |
| C.加入铜粉 | D.加人铁粉 |
下列实验中,溶液颜色不会发生变化的是
| A.Cl2通入NaOH溶液中 |
| B.碘酒滴入淀粉溶液 |
| C.SO2通入KMnO4/H+溶液中 |
| D.SO2通入品红溶液 |
海水是十分重要的资源,不需要化学方法就能从海水中获得的物质有
| A.氯、溴、碘 | B.食盐、淡水 | C.烧碱、氢气 | D.钠、镁、铝 |