甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
| i |
150 |
1/3 |
0.1 |
| ii |
|
|
5 |
| iii |
350 |
|
5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气) 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为;平衡时,气体的总物质的量是。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为。
一定条件下,可逆反应:A2+B2 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
请回答:
(1)a、b应满足的关系是 (2)a的取值范围是
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示: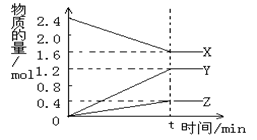
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是。
写出下列物质的电子式,有结构式的请写出结构式
①氨气、②氯化铵、
③干冰、④苛性钠、
⑤冰、⑥过氧化钠、
⑦双氧水、⑧HClO、
由锌和铜构成的合金共10 g,放入足量的稀盐酸中充分反应,产生标准状况下气体2.24L,试求合金中铜的质量分数。