小雷想知道小灯的亮暗程度与什么因素有关.于是找来额定电流均小于0.6A,额定电压是2.5V的灯L1和额定电压是3.8V的灯L2,先后接在电源电压恒为6V的电路中,按照如图所示的电路开始探究.
(1)请你用笔画线代替导线,根据上图所示的电路图,将下图所示实物图连接完整.
(2)若小雷连接好电路后闭合开关,灯L1几乎不发光,移动滑片P也不能改变灯的亮度.原因是他把滑动变阻器的 (选填“A、B”或“C、D”)接线柱接入了电路.
(3)小雷排除故障后,按上图所示的电路继续进行实验:
①闭合开关,滑片P向 (选填“A“或“B“)端移动,使灯L1发光,测出灯L1的相关物理量,记录和计算结果如下表:
| 次数 |
电压/V |
|
实际功率/W |
电阻Ω |
| 1 |
1.6 |
O.20 |
O.32 |
8.00 |
| 2 |
2.5 |
O.24 |
O.60 |
1O.42 |
| 3 |
2.8 |
O.26 |
O.73 |
1O.77 |
②请将记录数据时遗漏的物理量和单位填入表格的空格处.
(4)小雷注意到灯L1的亮度变化是:第二次比第一次亮,第三次比第二次更亮.结合表中数 据得出的结论是小灯泡越亮,它的实际功率越 .
(5)用L2替换L1重复上面的实验时,需要改变 表的量程,发现灯L2的亮度变化规律与灯L1相似.
(6)小雷在实验结束后与同学们讨论:
①有同学认为“用上表中灯L1的3次电阻的平均值代表它的电阻更准确.“这种说法错误的原因是小雷忽略了 对小灯电阻的影响.
②有同学认为“把灯L1换成定值电阻,该实验可以用来研究导体中的电流与电压的关 系.“你认为这种说法 (选填“正确”或“错误”).
物理与生活总是密切相关,很多有趣的物理实验也可以借助身边的用品进行探究。以下就是小明利用气球探究的一些小实验:
(1)将两只系着细线的气球在衣服上蹭来蹭去,当提起细线试图让两只气球靠近时,
出现了如图甲所示的排斥现象,这是因为摩擦使两气球带上了__ _____使气球相互远离;这时向两气球之间吹气,气球又相互靠近了,这是因为___________。
(2)为了观察压力的作用效果,用一个形状接近正方体的气球、几个相同的砝码、木板等进行实验。他们将一块与气球上、下表面大小相同的木板压在气球上,用改变砝码个数的方法改变木板对气球的压力大小。实验情况如图(a)、(b)和(c)所示。观察上述实验现象,归纳得出初步结论:
①由图(a)与(b)或(a)与(c)可知:力可以改变物体_____ _____;
②由图(b)和(c)可知:___________,压力的作用效果越明显。
(3)抛出一个气球,可以看到它下落的速度很慢,这是因为它受到_________的缘故;最终气球都将落回地面,这是因为地面附近的一切物体都受到________的作用。
小华利用如图实验装置来探究电磁铁的磁性强弱与哪些因素有关.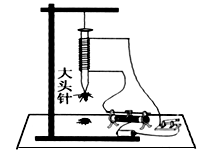
(1)小华是通过观察_______________来判断电磁铁磁性的强弱。
(2)电磁铁的磁性强弱与哪些因素有关(填写两点):
①;②。
(3)探究电磁铁的磁性强弱与上述两个因素的关系时,必须采用法.
(4)以下利用电磁铁特点工作的是(填写序号)。
| A.电子验钞机 | B.模型电动机 | C.电磁继电器 | D.手摇发电机 |
小华同学测滑轮组机械效率时所用的实验装置如图所示,小华同学对同一滑轮组进行实验探究,得到了下表中的数据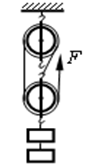
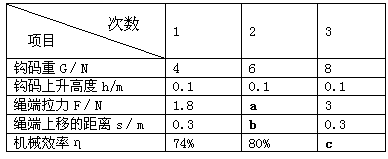
(1)将表中数据补充完整。a处填__________; b处填__________; c处填________
(2)实验中拉动弹簧测力计时,要注意让弹簧测力计沿着竖直方向做运动。
(3)分析比较表中的数据,你认为同一滑轮组机械效率发生变化的主要原因是 。
(4)如果继续增大钩码的重量,不计摩擦及绳重,滑轮组的机械效率将(选填“变大”、“变小”或“不变”)。
某校实验室购买了一批铭牌为“2.5V 0.75W”的小灯泡,小军同学利用其中一只灯泡做测量小灯泡电功率的实验。现请你帮他完成下面问题:
(1)用笔画线代替导线把如图甲所示的实物电路补充完整。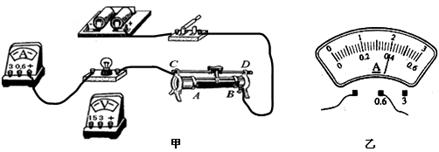
(2)在闭合开关前,滑动变阻器的滑片P应调至_________端(选填“A”或“B”)
(3)闭合开关并调节滑动变阻器,测得如下一组数据.其中第2次实验时的电流表示数如图14乙所示,则第二次测得的电流是A 。
| 实验次数 |
1 |
2 |
3 |
| 电压U/V |
2.0 |
2.5 |
3.0 |
| 电流I/A |
0.34 |
0.44 |
(4)小灯泡正常工作的电压是V,正常工作的功率是W。
(5)根据上面这组数据的分析,你认为该小灯泡是(选填“合格”或“不合格”)的。
(1) 如下图所示,是小丽同学在实验中所测量的数据,现请你填写测量结果:
甲图中这段铅笔的长度应是_______cm; 乙图中体温计的示数是℃;丙图中天平读数是g。
(2)如图所示,在研究光的反射规律实验中,平面镜M平放在平板上,E、F是两粘接起来的硬纸板,可绕垂直于镜面的接缝ON转动。
①如图甲,当E、F在同一平面上时,让入射光线AO沿纸板E射向镜面,在F上可看到反射光线,若将AO向ON靠近,则OB________ON.(填“靠近”或“远离”)
②如图乙,把半面纸板F向前或向后折,则_____(填“能”或“不能”)看到反射光线,说明反射光线与入射光线及法线ON在_________。