25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是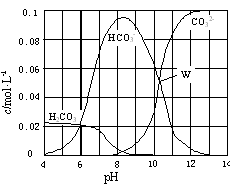
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为b mol。下列叙述,错误的是
A.溶液中c(H+) =
B.物质的量浓度c(HA) = mol·L-1
mol·L-1
C.t℃时,HA的溶解度S =
D.HA的质量分数w(HA) =
有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e- CO32-+7H2O
CO32-+7H2O
D.放电一段时间后,溶液的pH减小
下列叙述正确的是
| A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
| B.常温时,0.1mol/LHA溶液的pH>1,0.1mol/LBOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为: c(B+)>c(OH-)>c(H+)>c(A-) |
| C.过量SO2通入到Ba(NO3)2溶液中,离子反应方程式为: 3SO2+2NO3-+3Ba2++2H2O  3BaSO4↓+2NO↑+4H+ 3BaSO4↓+2NO↑+4H+ |
| D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb |
下列离子方程式书写正确的是:
A.硫酸亚铁加过氧化氢溶液:Fe2+ + H2O2 + 2H+ Fe3+ + 4H2O Fe3+ + 4H2O |
B.将少量硝酸银溶液滴入氨水中:Ag+ + 2NH3·H2O [Ag(NH3)2]+ + 2H2O [Ag(NH3)2]+ + 2H2O |
| C.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓+3BaSO4↓ |
D.铝粉与NaOH的D2O溶液反应:2Al + 2OH-+ 2D2O 2AlO2-+ H2↑+2D2↑ 2AlO2-+ H2↑+2D2↑ |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.标准状况下,0.1molCl2溶于水,转移的电子数目小于0.1NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |