乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中, 在标准状况下放出1.12LH2。求:
在标准状况下放出1.12LH2。求:
(1)产生H2的物质的量为多少?
(2)原混合物中金属钠的质量为多少克?
(3)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为多少?
随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注。下图是最近研发出的天然气利用新途径:首先甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后一氯甲烷在400°C的条件下通过分子筛催化转化为低碳烯烃。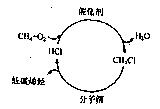
请根据以上信息回答下列问题:
(1)第一轮次反应投料时甲烷和氯化氢的最佳体积比(相同条件)为。
(2)由一氯甲烷生成丙烯的化学方程式为。
(3)按最佳反应投料比,若该途径中的第一步“甲烷氧氯化反应”的转化率为80%,经除水、分离出混合物中的一氯甲烷后,剩余CH4、O2和HCl全部留用并投入第二轮次生产;第二步一氯甲烷反应生成含有乙烯、丙烯、丁烯和氯化氢的混合气体,碳原子的利用率为90%,分离出其中的烯烃气体后,剩余HCl也全部留用并投入第二轮次生产,则:
①标准状况下,1m3甲烷经过一轮反应可得到kg乙烯、丙烯、丁烯的混
合气体。
②为了与第一轮次得到的等量的低碳烯烃,第二轮次反应投料时,需补充的CH4、
O2和HCl的体积比为(相同条件)。(请写出①和②的计算过程)
标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2和CO的质量和体积各为多少?
10g碳酸钙与足量盐酸反应,消耗盐酸的物质的量为多少?生成二氧化碳气体的体积(标准状况)为多少?
在标准状况下,2.24L HCl气体的质量为多少,将其溶于水,配成500ml盐酸溶液,所得溶液的H+ 的物质的量浓度?