在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1L0.1mol·L—1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH—)+c(SO42—)
B.0.1 mol·L-1NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
C.0.1mol·L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+)
下列说法中,不正确的是
| A.短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 |
| B.第三周期元素的离子半径大小比较:Cl->S2+>Na+>Mg2+>Al3+ |
| C.日本福岛核电站释放出的放射性核素131I与132I、133I互为同位素 |
| D.相同条件下,通过测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |
若用NA表示阿伏加德罗常数,下列说法中,正确的是
| A.12.5gCH2==CHCl和12.5g [ CH2—CHCl ]n中含氯原子数均为0.2NA |
B.18g2H2O和18g3H2O中含有的质子数均为10NA |
| C.23gNa与氧气完全反应,消耗氧气分子数一定为0.5NA | |
| D.84g NaHCO3固定和106g Na2CO3固体中CO2-3的数目均为NA |
下列判断中,正确的是
| A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物 |
| C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |
下列关于常见有机化合物的说法中,正确的是
| A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B.分子式为C5H12的有机物只有三种,它们互为同分异构体,性质完全相同 |
| C.甲烷、苯、乙醇、乙酸和乙酸乙酯都能发生氧化反应和取代反应 |
| D.糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
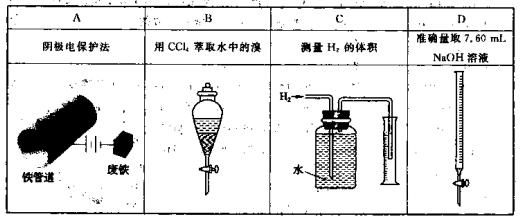
下列表格中的图 示内容符合文字说明要求的是
示内容符合文字说明要求的是