邻叔丁基对苯二酚(TBHQ) 是一种新颖的食品抗氧剂,其制备原理为:
实验过程中的主要步骤如下:
步骤1.向三口烧瓶中加入5.5g对苯二酚,5.OmL浓磷酸及20mL二甲苯(装置如图所示),启动搅拌器。
步骤2.缓缓加热到100-110°C,慢慢滴加7.5mL叔丁醇和5mL二甲苯组成的溶液,30-60min内滴完。
步骤3.升温到135-140°C,恒温回流2.5h。
步骤4.将反应液冷却到120°C,直到反应完成
步骤5.将反应液倒入烧杯,并用热水洗涤三口烧瓶,洗液并入烧杯中。
步骤6.冷却结晶,抽滤,回收滤液中的二甲苯和磷酸
步骤7.用二甲苯重结晶、脱色、冷水洗涤、干燥
(1)磷酸在实验中的作用是_____。
(2)本实验中二甲苯的作用是_____。
(3)步骤4中反应完成的标志是_____。
(4)步骤7脱色时,可用的脱色剂是_____。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是_____、_____。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水b.NaOH溶液
c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是。
(4)认为气体Y中还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a.A之前b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。
(10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、______和_____。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为____________________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
| 醋酸溶液浓度(mol·L-1) |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是_____________。
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案___________________。
(10分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实验。实验过程和记录如图所示(无关物质已经略去):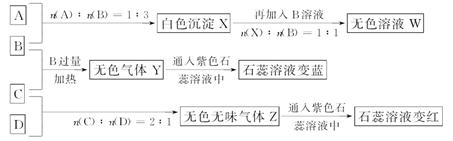
请回答:
(1)Y、Z的化学式分别为:Y________;Z__________。
X与B反应的离子方程式为_________________________________________________。
(2)D溶液pH________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)____________。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式______________________。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是___________。
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色。
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用。
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因_________________________________________________
(2)写出检验步骤②中沉淀是否洗涤干净的操作_____________________________________
(二)为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用下图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表: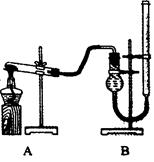
| 实验序号 |
KClO3质量 |
其他物质质量 |
待测数据 |
| ③ |
1.2g |
无其他物质 |
a |
| ④ |
1.2g |
CuO 0.5g |
b |
| ⑤ |
1.2g |
MnO2 0.5g |
c |
(3)写出氯酸钾分解反应的化学方程式,并用双线桥表示电子转移的方向和数目。
(4)上述实验中的“待测数据”是指________________________________________
(5)图中量气装置B由干燥管、乳胶管和50ml滴定管改造后组装面成,此处用滴定管是________(填“酸式”或“碱式”)滴定管
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积﹝V(O2)﹞随时间(t)变化的曲线(注明必要的标识)。
(7分)实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3—n/2]m和绿矾(FeSO4·7H2O),其过程如下:
(1)过程①中,FeS和O2、H2SO4反应的化学方程式是。
(2)验证固体W焙烧后产生的气体含有SO2的方法是。
(3)制备绿矾时,向溶液X中加入过量,充分反应后,经操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏(填“高”或“低”),过程②中将溶液加热到70~80 ℃的目的是。