对以下实验装置图的说法正确的是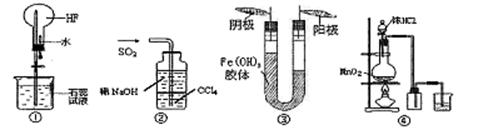
| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
| A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C.漂白粉、福尔马林、冰水、王水、氯水均为混合物 |
| D.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
列反应的离子方程式正确的是
| A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.钠与CuSO4溶液反应:2Na+Cu2+===Cu↓+2Na+ |
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O AlO2-+4NH4+ +2H2O AlO2-+4NH4+ +2H2O |
| D.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+ = Cu2+ + 2H2O |
NA为阿伏加德罗常数的数值。下列说法正确的是
| A.常温常压下,22.4 L的氧气中含氧原子数为2NA |
| B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C.乙烯和环丙烷组成的28 g混合气体中氢原子的个数为4NA |
| D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
化学与生产、生活密切相关。下列叙述正确的是
| A.六水氯化钙可用作食品干燥剂 |
| B.葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| C.为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
| D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌等疾病的发生不相关 |
在标准状况下,ag气体x与bg气体y的分子数相同,下列说法正确的是
| A.标准状况下,等质量的x和y体积之比为b:a |
| B.同温同压下,气体x和气体y的密度之比为 b:a |
| C.25℃时,1g气体x和1g气体y的分子数之比为b:a |
| D.同物质的量的气体x和气体y的质量之比为b:a |