一定温度下,在密闭容器内有如下化学反应平衡:CO+H2O(g)  H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
| A.0.5mol | B.0.6mol | C.0.9mol | D.2.5mol |
X、Y、Z、W有如右图所示的转化关系,已知焓变:
△H=△H1+△H2,则X、Y可能是
①C , CO②AlCl3, Al(OH)3③Fe , Fe(NO3)2 ④FeBr2, FeBr3
| A.①②③④ | B.①② | C.③④ | D.①②③ |
自来水加工处理流程如下,下列有关说法不正确的是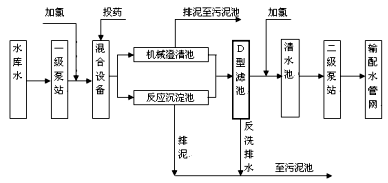
| A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 |
| B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 |
| C.自来水生产中,前加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染 |
| D.用ClO2消毒自来水,消毒效率是同质量氯气的2.63倍 |
下列离子方程式不正确的是
A.用两个铜电极电解食盐水:2Cl-+2H2O  2OH- + H2↑+ Cl2↑ 2OH- + H2↑+ Cl2↑ |
| B.AgCl悬浊液中加入硫化钠饱和溶液:2AgCl + S2-=Ag2S +2Cl- |
| C.Ca(HCO3)2溶液中加入过量KOH溶液:Ca2+ + HCO3- +OH- =CaCO3↓+ H2O |
| D.Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
| A.2.24LCl2中含有的原子数一定为0.2 ×6.02×1023 |
| B.0.1L2mol·L-1的Na2CO3溶液中含有的CO32-数目为0.2 ×6.02×1023 |
| C.0.88gC3H8中含有的共价键总数目为0.2 ×6.02×1023 |
| D.7.8g过氧化钠粉末与水反应转移的电子数为0.2 ×6.02×1023 |
下列说法不正确的是
A.BaCrO4(s)  Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 |
| B.pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 |
C.苯酚显色原理为:6C6H5OH+Fe3+ Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸( Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸( )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 |
| D.某试液中加入盐酸酸化的氯化钡溶液有白色淀淀,该试液中一定含有SO42- |