用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+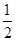 O2(g)=H2O(l) ΔH=-285.84kJ/mol
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
| A.-417.91kJ·mol-1 | B.-319.68 kJ·mol-1 |
| C.+546.69 kJ·mol-1 | D.-448.46 kJ·mol-1 |
下列氧化物按其形成的含氧酸酸性递增顺序排列的是()
| A.SiO2<CO2<SO3<P2O5 | B.SiO2<CO2<P2O5<SO3 |
| C.CO2<SiO2<P2O5<SO3 | D.CO2<P2O5<SO3<SiO2 |
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第7周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是( )
| A.类铅元素原子的最外层电子数为4 |
| B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
A、B分别为第3周期和第4周期的同一主族不同元素的原子,它们原子核内质子数都等于中子数。①若A为ⅡA族,其质量数为x,则B的质子数为y。若A为ⅣA族,其质子数为m,则B的质量数为n。在下列各组值中,y和n的值分别是( )
A.(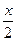 +18)和(2m+18) B.(
+18)和(2m+18) B.(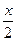 +8)和(2m+8)
+8)和(2m+8)
C.(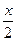 +8)和(2m+36)D.(
+8)和(2m+36)D.(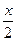 +18)和(2m+18)
+18)和(2m+18)
X、Y两元素的原子分别获得一个电子后能形成稀有气体的电子层结构,且X放出的能量大于Y,下列叙述错误的是( )
| A.还原性:X->Y- | B.氧化性:Y<X |
| C.原子序数:X<Y | D.还原性:X-<Y- |
某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是( )
| A.不能由此确定该元素的相对原子质量 |
| B.这种元素的相对原子质量为m+n |
| C.若碳原子质量为W克,此原子的质量为(m+n)W克 |
| D.核内中子的总质量小于质子的总质量 |