以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。
下列叙述正确的是
| A.Fe与S混合加热生成FeS2 |
| B.NaHCO3的热稳定性大于Na2CO3 |
| C.过量的铜与浓硝酸反应有一氧化氮生成 |
| D.白磷在空气中加热到一定温度能转化为红磷 |
污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 |
| C.硫酸钠溶液 | D.纯碱溶液 |
现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验: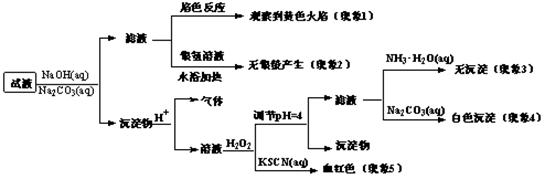
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。该同学得出的结论正确的是
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
向苏打和小苏打溶液中分别加入盐酸 |
均冒气泡 |
两者均能与盐酸反应 |
| B |
向AgNO3溶液中滴加过量氨水 |
溶液澄清 |
Ag+与NH3H2O能大量共存 |
| C |
将可调高度的铜丝伸入到稀NHO3中 |
溶液变蓝 |
Cu与稀HNO3发生置换反应 |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 |
下层溶液显紫红色 |
氧化性:Fe3+>I2 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
用热的烧碱溶液洗去油污 |
Na2CO3可直接和油污反应 |
| B |
漂白粉在空气中久置变质 |
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
| C |
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 |
K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D |
FeCl3溶液可用于铜质印刷线路板制作 |
FeCl3能从含有Cu2+的溶液中置换出铜 |