A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素, F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素。回答下列问题:
(1)写出E、F、G的元素符号 ,B、C、D元素的第一电离能由大到小的顺序是 (用元素符号表示),A元素分别与B、D元素形成的二种微粒都具有NH3相似的结构,属于等电子体,它们的化学式是 。
(2)F元素的原子基态价层电子排布图是 。
(3)向G的硫酸盐溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[G(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子G2+结合;NH3分子中N原子的杂化方式是________;
(4)E单质晶体中原子的堆积模型如右图,晶胞是图中的 (填a、b或c);配位数是 ;若紧邻的四个E原子的中心连线构成的几何体的体积是a cm3,E单质的密度为ρg/ cm3;则E的相对原子质量的计算式是 。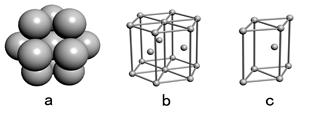
根据要求回答下列有关元素化合物的有关问题
I:我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物、悬浮颗粒物等三种大气污染物的浓度。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾d.白色污染
悬浮颗粒物可用高压电除尘是利用了_______现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置。它能将一氧化碳和NO在催化剂作用下发生反应转化为无害气体,其反应的化学方程式为_________ ___________.
(3)写出实验室中由固体物质制取氨气的化学方程式______________________________;
已知AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为___________。
II:铁在自然界存在广泛,在工业、农业和国防科技中有重要应用。
(1)用铁矿石(赤铁矿)冶炼生铁的原料中除铁矿石和焦炭外还有石灰石,写出石灰石除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为______________________________;高炉排出气体的主要成分有N2、CO2和________________(填化学式)。
(2)铁矿石中常含有硫,使高炉气中混有SO2污染空气。工业脱SO2的方法可以用______。(填字母序号)
a.氨水 b.浓硫酸 e.氢氧化钠溶液 d.稀硝酸
(3)配制的FeCl2溶液中会含有少量FeCl3,检验FeCl3常用的试剂是_________(填试剂的名称)。欲除去其中的FeCl3,应在该FeCl2溶液加入______________。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 (用必要的文字和离子方程式说明)。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl—)=5.3×10-2mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  ClO3-+
ClO3-+  Fe2++
Fe2++  =
=  Cl-+
Cl-+  Fe3++
Fe3++  .
.
在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)△H="a" KJ·mol-1体系中,n(NO)随时间变化如下表:
2NO2(g)△H="a" KJ·mol-1体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),
则a 0(填>,<或=)。
(2)用NO表示从0~2 s内该反应的平均速率v(NO)= 。
Ⅰ.用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: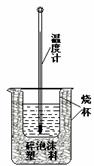
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和_ 。泡沫塑料的作用是 。
(2)若稀盐酸用相同体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):浓硫酸 ;稀硝酸 ;醋酸溶液 。
Ⅱ.如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管
(1)写出有关的离子方程式:______________________ 。
(2)烧杯中出现的现象为: 。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,如下反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2=________,反应
CO2(g)+H2(g)的平衡常数K2=________,反应 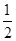 CO2(g)+
CO2(g)+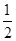 H2(g)
H2(g)
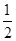 CO(g)+
CO(g)+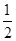 H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是______。(填编号)
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。