下列叙述正确的是
| A.对于平衡体系:H2(g)+I2(g)==2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
| B.—定温度下,物质的量浓度相同的4种溶液①CH3COONa②NaNO3③Na2CO3④NaOH,pH的大小顺序是④>③>①>② |
| C.0.1mol•L-1的氨水加水稀释后,NH3•H2O的电离程度增大,c(OH-)增大,c(H+)减小 |
| D.常温下,c(H+)/c(OH-)=10-10的溶液中:Na+、Al3+、SO-2-、NO3-可大量共存 |
下列关于碳氢化合物的叙述正确的是()
| A.碳氢化合物的通式为CnH2n+2 | B.石油的主要成分是碳氢化合物 |
| C.碳氢化合物中的化学键都是极性键 | D.乙炔是含碳量最高的碳氢化合物 |
下列化学用语正确的是()
| A.乙烯的实验式:C2H4 |
B.四氯化碳分子的电子式为: |
C.聚丙烯的结构简式为: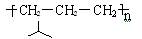 |
| D.异丁烷分子的键线式为: |
下列有机物在适量的浓度时,通常不能用于杀菌、消毒的是()
| A.苯酚溶液 | B.乙醇溶液 | C.甲醛溶液 | D.乙醚溶液 |
乙烯的产量作为衡量一个国家石油化学工业发展水平的标志,为了增加乙烯的产量,在石油加工时采用的措施是()
| A.减压分馏 | B.干馏 | C.裂解 | D.催化裂化 |
120℃、101.3kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为
| A.2∶1 | B.1∶2 | C.1∶7 | D.7∶1 |