常温下,0.1mol/L氨水溶液中 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
| A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L |
| B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+) |
| C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
下列化学用语和叙述正确的是
| A.葡萄糖的实验式:CH2O |
B.Na2O2的电子式: |
C.表示乙炔“燃烧热”对应的热化学方程式:C2H2(g)+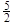 O2(g) = 2CO2(g)+H2O(g);?H =-1 256 KJ/mol O2(g) = 2CO2(g)+H2O(g);?H =-1 256 KJ/mol |
| D.M与N是同素异形体,由M = N;H =+119 KJ/mol可知,N比M稳定 |
下列实验现象预测正确的是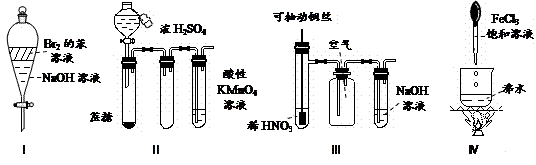
| A.实验Ⅰ:振荡后静止,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:①蛋白质的变性②蛋白质的盐析③胶体的聚沉④盐类水解⑤焰色反应⑥氧化还原反应
| A.①②③④ | B.①③④⑥ | C.②③④⑤ | D.②③⑤⑥ |
下列说法正确的是()
| A.溴乙烷与NaOH的乙醇溶液共热生成乙烯 |
| B.蛋白质、乙酸、葡萄糖均属电解质 |
| C.纤维素与淀粉遇碘水均显蓝色 |
| D.乙酸乙酯和食用植物油均可水解生成乙醇 |
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.澄清透明的溶液中:Cu2+、Fe3+、NO3—、Cl— |
| B.使pH试纸变深蓝色的溶液中:NH4+、Na+、SO42—、Cl— |
| C.含有大量ClO—的溶液中:K+、Na+、I—、SO32— |
| D.c(Al3+) = 0.1 mol·L—1的溶液中:Na+、NH4+、AlO2—、SO42— |