利用下列实验装置进行的相应实验,不能达到实验目的的是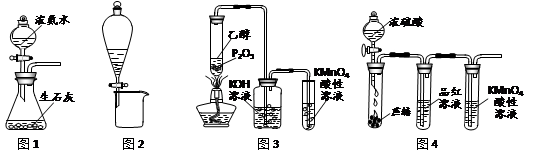
| A.用图1所示装置可制取氨气 |
| B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液 |
| C.用图3所示装置可制取乙烯并验证其易被氧化 |
| D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8 B.n+18 C.n+20 D.n+32
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是
| A.X可能是第二周期非金属元素 | B.X可能是第三周期金属元素 |
| C.Y可能与X同主族 | D.Y一定是金属元素 |
.NA表示阿伏加德罗常数,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.1.7g H2O2中含有的电子数为0.9 NA |
| C.1mol Na2O2固体中含离子总数为4 NA |
| D.标准状况下,2.24L甲烷所含共价键数为0.1 NA |
下列反应既属于氧化还原反应,又是吸热反应的是( )
| A.铝片与稀盐酸的反应 | B.Ba(OH)2•8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在氧气中的燃烧反应 |
已知R2+离子核外有a个电子,b个中子。表示R核素符号正确的是
A.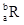 |
B. |
C. |
D. |