把CoCl2溶解于浓盐酸中,溶液中存在下列平衡:
Co2+ + 4Cl— CoCl4— △H>0
CoCl4— △H>0
粉红色 蓝色
有关上述可逆反应的下列说法不正确的是 ( )
| A.对溶液所在体系加热,溶液蓝色加深 |
| B.对溶液所在体系用冰水降温,上述反应的平衡常数减小 |
| C.室温下,加水稀释,上述反应的平衡常数减小 |
| D.室温下,加水稀释至一定范围,溶液为粉红色 |
下列离子方程式正确的是
| A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.氯乙酸与足量的氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO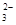 |
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O |
星际空间存在着以分子形式存在的星际物质。下表列出了某些星际分子发现的年代,下列有关说法正确的是
| 发现年代 |
1971年 |
1976年 |
1977年 |
1978年 |
1982年 |
| 星际分子 |
氰基乙炔(HC3N) |
氰基丁二炔(HC5N) |
氰基己三炔(HC7N) |
氰基辛四炔(HC9N) |
氰基葵五炔(HC11N) |
A.五种氰基炔互为同分异构体
B.五种氰基炔互为同系物
C.HC11N 属于高分子化合物
D.分子中三键个数的两倍与碳原子个数的差值为1
结构为 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
①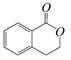 ②
② ③
③ ④
④ ,
,
生成这四种有机物的反应类型依次为:
| A.取代、消去、酯化、加成 | B.酯化、消去、缩聚、取代 |
| C.酯化、取代、缩聚、取代 | D.取代、消去、加聚、取代 |
将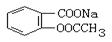 转变为
转变为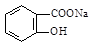 的方法为:
的方法为:
| A.与足量的NaOH溶液共热后,再通入CO2 |
| B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3 |
| D.与稀H2SO4共热后,加入足量的NaOH |
苯环结构中不存在碳碳单键与碳碳双键的交替结构,可以作为证据的是
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m
| A.①②④⑤ | B.①②③⑤ | C.①②③ | D.①② |