用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: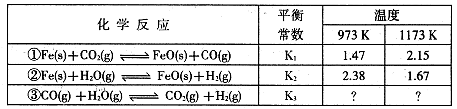
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: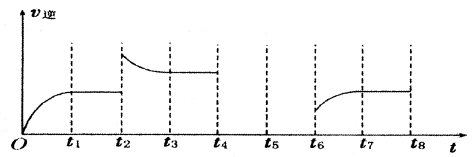
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。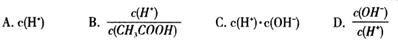
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
| ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
| 原子半径(10—10m) |
1.5 |
2.2 |
0.7 |
1.4 |
0.7 |
1.1 |
0.9 |
1.8 |
0.7 |
0.7 |
| 最高价态 |
+1 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
— |
| 最低价态 |
— |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-1 |
(1)以上10种元素的原子中,最容易失电子的是(填写元素符号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是、(写分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核 电荷数A<B<C<:D<E,其中A、B、C是同一周期的非金属元素。化合物DC中存在离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C氢化物的沸点比它们同
电荷数A<B<C<:D<E,其中A、B、C是同一周期的非金属元素。化合物DC中存在离子键,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C氢化物的沸点比它们同 族相邻周期元素氢化物的沸点高。E的原子序数为24。
族相邻周期元素氢化物的沸点高。E的原子序数为24。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的中心原子采取杂化。
(3)写出化 合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为一
合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为一
(4)E的核外电子排布式是。
A、B两元素在周期表中位于同一周期,核电荷数均小于36,最外层均为一个电子,A的次外层为8个电子,B的电子排布式为ls22s22p63s23p63d104s1(或[Ar] 3 dl0
dl0 4s1),则A元素的核外电子排布图为:;
4s1),则A元素的核外电子排布图为:;
B的元素符号为____,位于周期表第周期族。
把CoCl溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,生成[CO(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。请写出表示此配合物结构的化学式:;此配合物中的Co化合价为。
元素X的原子最外层电子排布式为nsnnpn+l。原子中能量最高的是电子;元素X的氢化物的分子结构呈形;该氢化物可以与H+离子以____键相合。